微流控芯片的單細胞藥物篩選分析
由于細胞之間的異質性,不同的細胞對某些藥物有不同的反應。盡管使用傳統小型化微量滴定板進行藥物篩選已經很好地建立起來并且易于執行,但單細胞藥物篩選仍然面臨一些技術障礙,包括在開放環境中分散液體的不受控制的蒸發。傳統的小型化微滴定板只能靜態培養細胞,這限制了它們的適用性,因為這種方法無法模擬自然的細胞外微環境。相比之下,微流體裝置可以通過連續輸注進行3D細胞培養,使其能夠模擬體內與細胞生理學相關的微環境,同時具有低樣品消耗、低成本和高通量的優點。Brouzes等人提出了一種基于液滴的微流體裝置,可以實現藥物庫對U937細胞的細胞毒性作用。在他們的方法中,他們首先用獨特的熒光標記藥物濃度庫,并將其與含有單細胞的液滴結合。將合并的液滴孵育24小時,然后注射到另一個設備中,與含有細胞活性熒光染料的液滴融合,然后在芯片上短暫孵育。最后,進行熒光分析以揭示單細胞的異質性。由于其精確的細胞包封、高通量液滴的產生和操作,以及用于聯合篩選的潛力,該設備代表了單細胞藥物篩選的理想平臺。最近,Scheler等人開發了一種基于液滴的數字最小抑菌濃度篩選,作為量化抗生素表型反應的單細胞分布的實用分析平臺,并允許高精度地測量接種物效應(圖8A)。根據頭孢噻肟治療攜帶β-內酰胺酶的大腸桿菌的結果,他們發現抗生素療效取決于每個細菌菌落形成單位使用的抗生素量,而不是絕對抗生素濃度。
與流式細胞術分析不同,單細胞藥物篩選試驗是使用微滴方法進行的,其中將選定的化合物添加到分離的單個細胞中,而不是添加到細胞群中。這使得細胞之間的相互作用得以避免,并且由于不同的細胞對藥物具有不同的敏感性,因此有可能從細胞群中分離出耐藥細胞以進行進一步分析,從而有可能為癌癥早期治療的新藥開發提供條件。例如,Sarkar等人使用集成微流體液滴陣列平臺分析了阿霉素在野生型和耐阿霉素乳腺癌癥細胞中的攝取和細胞毒性(圖8B)。他們發現,在存在或不存在阿霉素(Dox)的情況下,藥敏細胞比耐藥細胞更容易死亡。他們還觀察到單個藥物敏感細胞的多相攝取,而耐藥細胞的攝取和保留率較低。Bithi等人提出了一種基于移液管的微流體細胞分離技術,用于生成微滴陣列。他們的平臺可用于小樣本體積內少量腫瘤細胞或腫瘤細胞簇的單細胞藥物分析。他們使用該平臺對腫瘤細胞對阿霉素的反應進行了單細胞分析,發現盡管單個腫瘤細胞的藥物攝取不同,但凋亡的發生是由阿霉素關鍵細胞內濃度的積累決定的。他們的方法為理解腫瘤細胞-藥物相互作用提供了一個理想的平臺。
單細胞遺傳分析
細胞之間的遺傳差異在發育、分化、信號轉導和疾病中非常顯著,開發單細胞基因分析方法來探索這些生命過程非常重要。除了單細胞分離外,液滴微流體還成為分離單細胞基因組的有前景的工具,使其成為細胞生物學和臨床醫學單細胞基因組學高通量研究的理想技術。
Lan等人描述了一種使用微流控液滴技術進行超高通量單細胞基因組測序的方法(圖9A)。在他們的方法中,單個細胞被包裹在微凝膠中,微凝膠可以滲透酶、洗滌劑和水力直徑小于其孔徑的小分子等分子,但也可以在空間上捕獲基因組DNA等大分子。微凝膠的使用有助于清潔包封的細胞,以執行必要的步驟,如細胞裂解和基因組處理,同時保持單個基因組的分離。使用他們的方法,他們很容易對包封的細胞進行一系列操作,如細胞裂解和基因組處理,同時保持單個基因組之間的分區。通過將微凝膠和微流控液滴技術相結合,他們的方法可以在短時間內處理5萬個細胞,實現超高通量單細胞基因組測序。然而,它們的封裝過程遵循泊松分布,導致封裝率低。此外,Moon等人開發了一種新的液滴微流體平臺,其中含有寡核苷酸條形碼的高濃度微珠在慣性作用下自發排列在螺旋通道中,然后與液滴中的單個細胞共封裝以進行單細胞測序(圖9B)。通過慣性有序珠的確定性封裝,他們的平臺顯著提高了吞吐量并減少了條形碼錯誤,相對于非確定性Drop-seq系統,顯著減少了多珠包裝中的間歇性錯誤。Guo等人開發了一種快速、無PCR的單細胞miRNA檢測方法,在帶有光電倍增管(PMT)傳感器的液滴微流體平臺中使用DNA雜交鏈式反應擴增靶miRNA信號(圖9C),其中單細胞和裂解物被包裹在液滴中,單個細胞釋放的靶miRNA與DNA放大器相互作用,引發雜交反應并產生熒光信號。靶序列在不使用PCR熱循環的情況下循環,以顯著放大熒光信號。他們的方法有效地將實驗室臺式PCR分析轉化為實時液滴分析,使用反應后熒光進行讀取,以實現超高通量單細胞測序(每分鐘300-500個細胞),用于快速生物醫學鑒定。此外,Segaliny等人報道了一種單細胞液滴微流體方法,通過動態監測TCR T細胞活化、逆轉錄PCR和單細胞水平的TCR鏈測序來鑒定表達工程化T細胞受體(TCR)的T細胞。
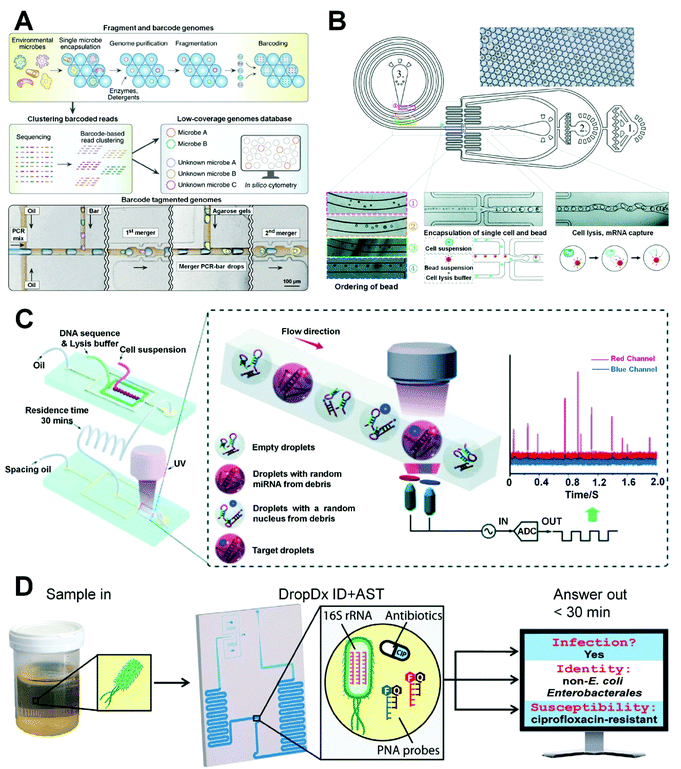
最近,基于單細胞液滴微流體的遺傳分析越來越多地被研究學者應用于臨床診斷。Rivello等人描述了一種研究與轉移性疾病相關的循環基質細胞代謝的通用方法,以使用基于液滴的微流體芯片揭示前列腺癌癥的預后。他們對轉移性癌癥前列腺患者的單細胞進行液滴內細胞外pH測量,以檢測和分離高代謝活性細胞(HMCs)。然后對HMCs進行單細胞mRNA測序分析,結果顯示約87%是高代謝的循環基質細胞。Kaplan-Meier分析顯示,HMCs超過5的患者的生存概率明顯低于HMCs少于5的患者。因此,HMCs可能是癌癥預后不良的指標。單細胞液滴微流體方法對前列腺癌癥的診斷具有潛在的實用性。此外,王的團隊建立了一個基于單細胞液滴的微流體系統,用于臨床尿液樣本的病原體鑒定和抗菌藥物敏感性測試(圖9D)。使用153個熒光雜交探針檢測微滴中單個細菌的16S核糖體RNA(16S rRNA),從而在16分鐘內從臨床尿液樣本中分子鑒別尿致病菌,并定量指示細菌對抗生素的敏感性。微流體系統在短周轉時間(<30分鐘)內實現了尿液病原體分析的卓越性能。使用基于液滴的微流體對臨床樣本中的單細胞進行多樣性遺傳分析,對于加速臨床診斷/治療和精準醫學的發展非常有價值。
在這篇綜述中,我們介紹并討論了單細胞液滴微流體在生物醫學應用方面的最新進展。微流體液滴技術從重要優勢、無量綱數、裝置幾何形狀和液滴產生等方面進行了介紹。描述并討論了基于隨機或受控模式在液滴中以及使用合成或天然聚合物在水凝膠中用于單細胞包封的各種最新微流控液滴操縱方法。最后,我們總結了單細胞液滴微流體在小分子檢測、蛋白質分析、藥物篩選和遺傳分析中的重要應用。
盡管使用微流控液滴技術在單細胞操作和分析方面取得了一些進展,但仍然存在瓶頸。首先,微流控液滴技術的單細胞包封率較低,用于單細胞分析的檢測工具在數量上仍然有限,靈敏度相對較低。開發更簡單、更便宜、更集成的液滴微流體裝置將顯著改善單細胞分析。此外,用于包封單細胞的凝膠材料在功能上是有限的,有必要開發用于培養的多復合/功能凝膠材料,以有效地重建體內細胞的3D微環境,用于單細胞的高通量分析。最后,細胞本身的復雜性以及單細胞分析的當前趨勢涉及多模式表征的事實,鼓勵了同步檢測更多類型細胞間分子的方法的發展。這些挑戰將促進液滴微流體在操作和檢測目的以及多組分單細胞分析中的進一步發展,為單細胞的進一步生物醫學研究提供科學依據,并導致對生物過程中涉及的分子的功能和調控機制的更準確和全面的理解。
免責聲明:文章來源網絡 以傳播知識、有益學習和研究為宗旨。轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除。
標簽: 微流控芯片
- 上一條沒有了
- 下一條連續流光化學微反應器選擇問題與挑戰

