微流體使智能微膠囊能夠實現量身定制的遞送和控制釋放(下)
4.用于控制釋放的微流體輔助智能微膠囊
到達指定位置后,控制膠囊在膜上的釋放是最終交付的必要步驟。歐洲指令(3AQ19a)提供的控制釋放的定義是,當受到特定刺激時,在指定的時間間隔內分配密封劑。控制釋放的基本機制對于設計釋放曲線和釋放程序至關重要。本章以釋放機制為起點,介紹了由智能全膜和智能開關門以及釋放動力學調整的受控釋放程序。
基于膜破裂的智能微膠囊用于爆裂釋放。釋放機制包括溶解、崩解、膨脹和滲透,有助于基于膜的破裂,導致爆裂釋放。膜破裂的變化分為化學和物理變化。
化學變化包括交聯的化學裂解和引發解聚。例如,具有由核酸橋交聯的富含胞嘧啶外殼的微膠囊可以在pH 5.0下進行切割,導致外殼分解和pH觸發的膠囊釋放。使用多酚單寧酸作為交聯劑制備超分子微凝膠,所得智能微凝膠由于在高pH下脫質子化誘導的分解而表現出pH響應性爆發釋放。此外,通過外殼降解產生了pH酶延遲結腸靶向遞送,其中約20%的蛋白質在胃和小腸液中釋放,約58%在含有β-葡萄糖苷酶的結腸液中釋放。此外,具有可解聚膜的載體通過在所需刺激下解聚外殼來提供可調的觸發釋放。使用聚鄰苯二甲醛作為可解聚聚合物,制備了氟化物響應性微膠囊,其中氟化物暴露導致端蓋斷裂、從頭到尾快速解聚和膠囊釋放。一氧化氮(NO)表達隨著腸道炎癥而增加,可用于通過將益生菌嵌入聚γ-谷氨酸微膠囊來設計NO響應性遞送。如圖10(a)所示,外殼的解離伴隨著NO轉化為三氧化二氮,并與交聯劑鄰苯二胺發生不可逆反應,使益生菌能夠快速釋放以應對NO。
物理變化,包括溶脹/去溶脹或滲透誘導的破裂、熔融/溶解誘導的分解和機械誘導的破碎,為觸發釋放提供了一種替代策略,避免了對具有多種功能的復雜殼合成的需要。例如,創造了具有水觸發釋放的水凝膠外殼,其中吸水導致水凝膠膨脹約40%,從而釋放包封的殺生物劑。利用滲透特性增加膜的尺寸和厚度,制造了具有超薄外殼(0.83-2.80微米)的亞毫米膠囊,并很容易壓縮破裂,釋放出用于化妝品應用的密封劑。受噴射植物噴射種子的啟發,生產了具有PNIPAM外殼的微膠囊,并實現了熱觸發噴射釋放,由于內部壓力的增加,這種微膠囊可以在更高的溫度下收縮和破裂。使用棕櫚油基外殼,當溫度高于熔點38°C,如圖10(b)所示。通過將蟲膠聚合物摻入殼中,制備了具有pH觸發釋放的微膠囊,因為羧基被電離,殼最終在堿性pH下溶解,用于靶向腸道釋放。一個有趣的設計是使用熱誘導微裂紋釋放活性材料,用于制備應用于重金屬離子去除的氨基官能化膜。
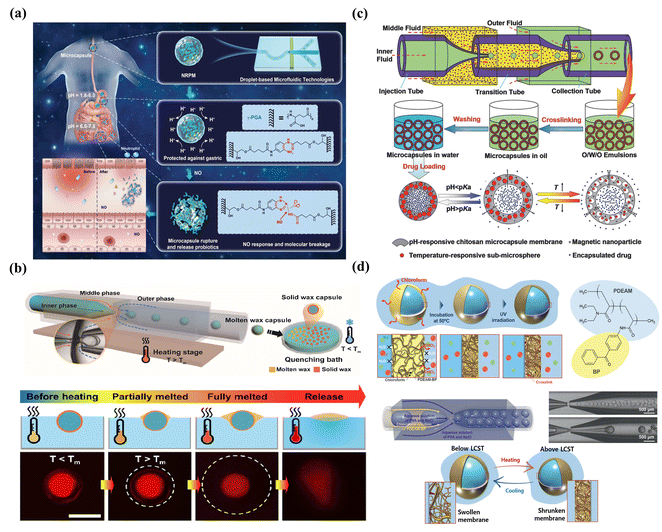
傳統的單刺激觸發微膠囊通常表現出突發釋放,這可能不適合某些應用,如口服給藥。開發具有多種刺激的微膠囊至關重要。這可以通過將多種刺激響應材料或顆粒摻入聚合物殼中來實現。例如,通過將光熱金納米顆粒嵌入熱敏聚合物膜中,產生了光響應和熱響應聚合物體。同樣,通過首先構建pH響應的殼聚糖交聯膜,然后將磁性納米顆粒和丙烯酰胺亞微球摻入其中,制備了多刺激響應微膠囊,如圖10(c)所示。
4.2.2具有基于膜的滲透性改變的微膠囊,用于持續釋放。將包封的活性材料長時間保持在一定濃度和預定速率,而不是突然釋放,這一點非常重要,特別是對于藥物給藥。用于持續釋放的載體通常設計有可調的滲透性膜,作為控制擴散進出的守門人。直接制造膜作為擴散屏障是實現持續釋放的簡單方法。此外,導致網眼尺寸變化的釋放機制,包括膨脹、滲透和部分降解,有助于基于膜的滲透性改變以實現持續釋放。
直接制造膜作為擴散屏障會影響密封劑的擴散速率,從而實現持續釋放。值得注意的是,調整外殼厚度是控制持續釋放的一種簡單方法。例如,通過調節單體的濃度,厚度從70 nm調節到150 nm,持續釋放的時間從3個月控制到5個月。可生物降解的殼,如可生物降解材料PLA、PLGA、和紫杉醇、也被用于控制殼厚度,從而影響包封劑的持續釋放擴散速率。在降解過程中,局部環境條件,如pH值,會影響降解速率,需要考慮。值得一提的是,核心成分可以增加擴散路徑,從而延長包封物質的釋放時間。正如Kim等人所報道的那樣,具有水凝膠核心的微膠囊在最初的幾分鐘內沒有釋放,而沒有水凝膠核心的對照組在35秒內立即釋放了一半的膠囊。由于出色的吸水能力,水凝膠是持續釋放膜材料的良好候選者。盡管大網眼水凝膠的固有網絡結構能夠進行分子交換,但水凝膠微膠囊不太適合釋放小分子以實現持續釋放。為了解決這個問題,Hu等人制造了具有兩層不同外殼的微膠囊,實現了親水性小分子羅丹明6G.的顯著緩慢釋放功能材料與刺激誘導的膜構象變化和滲透性改變的結合賦予了載體可調的尺寸選擇性滲透截止閾值。通過識別不同的刺激,如pH值、溫度、和光照,可以改變滲透性。如圖10(d)所示,使用具有體積相變溫度(VPTT)特性的聚(N,N-二乙基丙烯酰胺)作為中間相,溶脹程度隨著溫度的升高而逐漸降低,形成網眼尺寸小、滲透性低的塌陷網絡。定量地說,由于滲透性隨溫度的變化,膜的網眼尺寸在4°C和25°C時分別在2.8 nm和4.6 nm之間。膜的截止閾值可以通過調節功能單體的摩爾質量來控制。理論上,影響VPTT變化的因素可用于控制熱響應聚合物的膨脹和收縮,從而控制滲透性。在此基礎上,制備了葡萄糖響應性微膠囊。Zhang等人采用3-丙烯酰胺基苯基硼酸作為葡萄糖傳感器,帶電形式能夠與葡萄糖穩定形成絡合物,這改變了解離平衡,并將PNIPAM的VPTT轉移到更高的溫度,導致葡萄糖誘導的溶脹。或者,通過pH誘導的聚電解質質子化/去質子化,膜中的溶脹/收縮變化可能負責控制滲透性。一個有趣的設計是使用具有pH響應溶脹特性的聚丙烯酸來制造增壓室,為藥物室的釋放提供驅動力。
基于膜的滲透性改變的最大優點是,與基于膜的破裂相比,它可以避免殼體的不可逆變化和結構損傷,這在設計可逆和動態可調的釋放時非常重要。如圖11所示,使用硫烯聚合,制備了聚酸酐微膠囊,然后在其水性環境中水解,產生了帶有連接羧酸的交聯聚酸微膠囊,使微膠囊具有pH響應特性。更重要的是,酸酐在高pH值下的脫質子化增加了膜的網眼尺寸和親水性,增加了滲透性,導致膜的無損和可逆膨脹。此外,即使在室溫下真空干燥后,動態膜也可以在不可滲透和可滲透之間多次切換。
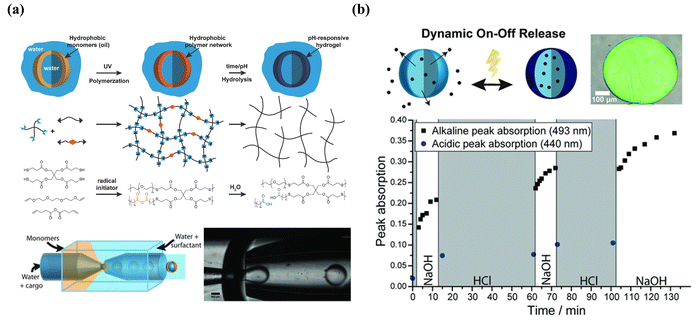
4.2.3程序化順序釋放的組合釋放曲線盡管智能微膠囊在不同刺激條件下實現了可控釋放并擴大了應用領域,但它們可能無法滿足特殊條件下的可控順序釋放要求。盡管通過提供一種簡單的順序釋放方法來控制殼厚度,但它將釋放時間從2分鐘延遲到15分鐘,殼厚度從500納米延遲到4μm。通過靈活的設計和組合釋放機制制造具有程序化順序釋放的微膠囊非常重要。
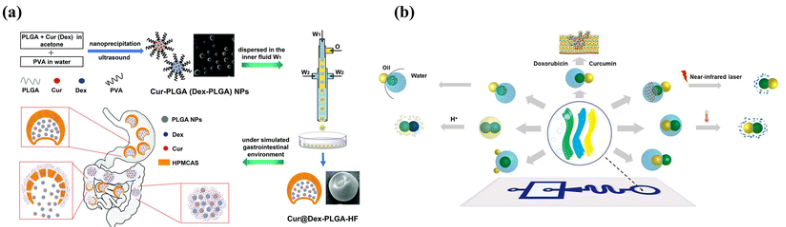
通常,程序化序列釋放可以通過設計具有核殼結構或多室結合不同釋放機制的智能微膠囊來實現。如圖12(a)所示,通過將游離藥物包封在殼中并將載藥納米顆粒包封在芯中,設計了具有突發持續釋放的納米級微膠囊。由于殼聚糖殼的分解,游離藥物可以快速釋放,而載藥PLGA納米顆粒由于PLGA的降解而提供了二次持續釋放。另一種順序釋放的方法是利用多室微膠囊。Xu等人開發了pH和溫度響應的微膠囊,外殼中含有疏水性物質,核心中含有親水性物質,可與不同的刺激物一起實現順序釋放。考慮到具有多隔室的智能微膠囊用于程序化順序釋放,制備了膠囊中膠囊結構(殼聚糖外殼和PEGDA外殼),實現了第一次酸觸發的突發釋放,隨后實現了可持續釋放。同樣,生產了具有PEG-b-PLA二嵌段共聚物雙層的聚合物中聚合物組,以實現程序化釋放。使用負載PLA均聚物的雙層作為外膜,可以從最內層到最外層順序破裂膜,控制核心材料的釋放。將PLA均聚劑摻入雙層可以提高機械和化學穩定性,即使在高滲沖擊下也能防止膜破裂。利用相分離產生的具有復雜結構的Janus微粒的優勢,具有不同降解特性的多相Janus系統實現了區域藥物裝載和程序釋放。如圖12(b)所示,將相變材料引入不同的入口以制造液滴,并通過調節微流體系統中的界面張力來改變結構,從而實現程序化降解和釋放。
4.2.4具有基于門的控制釋放的智能微膠囊具有智能開/關的微膠囊通常是通過使用智能聚合物材料或微球作為智能門的“接枝”和“接枝”方法制造的。微膠囊的最終基質沒有環境響應,控釋性能僅取決于突然的正響應或負響應門。正向響應門控在遇到刺激時會增加滲透率,而負向響應門控則表現出相反的特性。
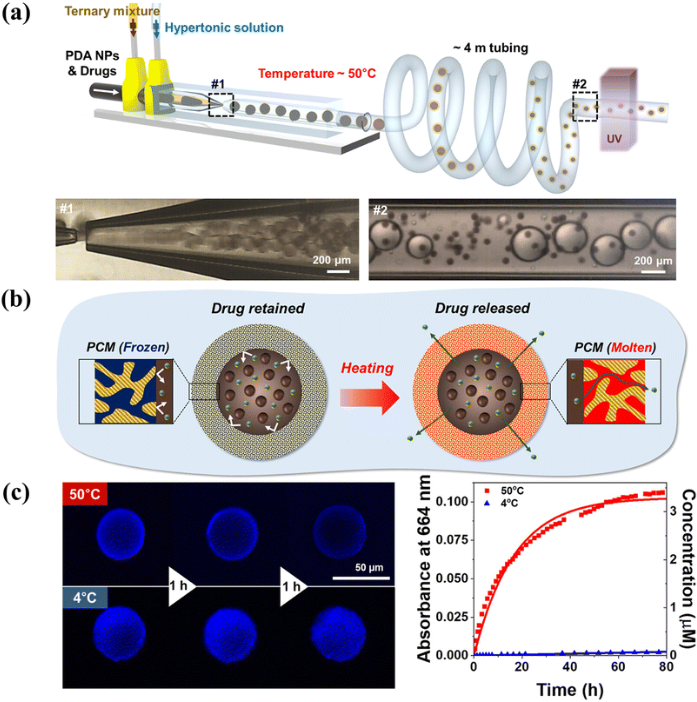
根據柵極材料是在膜形成后還是在膜形成過程中加入的,智能柵極的制造方法可分為兩類:“接枝”技術和“混合”技術。盡管人們已經集中精力通過本體接枝或共混來突出智能門控膜,但只有少數文章關注微流體輔助的智能門控膜用于控制釋放。需要提前澄清的一點是,多孔微膠囊不是本節的重點,盡管在其他論文中它們可能被稱為智能門控多孔顆粒。考慮到散裝混合過程可以在有限的空間內分離,例如微流體制造的乳液液滴的薄中間層,因此有可能構建具有智能門控的微膠囊。一個例子是Kim等人制造的具有分子極性和溫度依賴性滲透性的微流體制備的W/O/W乳液模板智能微膠囊。通過將十二烷醇、丙烯酸月桂酯(LA)和三羥甲基丙烷乙氧基化物三丙烯酸酯(ETPTA)的三元混合物作為中間油相混合,LA和ETPTA在光聚合時形成聚合物框架,同時用液體十二烷醇填充連續的空隙。連續十二烷醇作為智能門,當高于十二烷醇的熔點時,選擇性地允許可溶于熔融十二烷醇中的分子擴散穿過膜。同樣,使用十二烷醇連續納米通道作為跨膜轉運的智能門(圖13),智能微膠囊在近紅外激光照射下顯示出高性能的光熱加熱,這歸因于核心中的聚多巴胺納米顆粒,并實現了按需藥物釋放。
4.3釋放動力學
通過研究釋放動力學,可以控制和設計用于靶向遞送的密封劑的最佳釋放。各種因素影響微膠囊的釋放動力學,包括生產條件和形態。例如,不同的生產方法,如微流體和批量制造,會導致不同的釋放動力學。由于尺寸分布均勻,微流控微膠囊的初始爆發和釋放速率比傳統微膠囊慢。尺寸和尺寸分布也起著重要作用。與較小的微膠囊相比,具有精細尺寸分布的較大微膠囊顯示出較少的初始爆發和較長的釋放過程,這歸因于較長的擴散路線和較小的表面積體積比。此外,結構和形態會影響釋放動力學。與具有相同包封直徑的單層微粒相比,核殼微膠囊的初始釋放速率更高,這可能是由于核殼結構的表面積與體積比更大。微膠囊內的不同隔室表現出不同的釋放動力學,與外殼相比,內部隔室的釋放速率較慢,受物理滲透壓和擴散距離的影響。此外,微膠囊殼的結構,如孔的厚度和表面覆蓋率,會影響釋放動力學,較厚的膜和較小的孔表面覆蓋率表現出更高的爆發釋放和更短的釋放時間。
數學模型對釋放動力學非常有幫助,因為它們可以預測靶位點之前的釋放過程并測量重要的物理參數,這使得它們在不同的靶遞送動力學中得到了廣泛的應用。各種數學方程用于描述活性材料的動力學釋放,如表7所示。在這些動力學方程中,零階、一階、和Higuchi模型是最常用的。例如,包封檸檬醛的藻酸鹽微膠囊表現出一級模型很好地描述的釋放特性,能夠持續釋放。具有親水性生物活性的可生物降解微膠囊隨著膜的降解表現出長期釋放,具有雙指數功能。然而,由于復雜性和對相關因素的敏感性,沒有一個單一的方程被普遍接受來準確描述釋放動力學。
5.結論和展望
總之,對于智能微膠囊來說,重要的一步不僅是根據最終應用選擇包封載體進行包封,還包括靶向遞送和控釋,包括釋放位點和模式。基于液滴的微流體技術為制造微膠囊提供了最有效的方法,因為它在低能量需求的微米尺度上精確地操縱流體。在這篇綜述中,我們討論了微流體輔助微膠囊從液滴制造和載體系統到靶向遞送和控制釋放的過程。盡管在探索智能微膠囊方面取得了重大進展,但還需要進一步努力,使微膠囊具有高通量生產率、優異的機械性能、出色的主動靶向功能和可控的釋放性能。
首先,實現“智能靶向”是微膠囊靶向遞送的一個關鍵方面。盡管人們已經做出了相當大的努力,通過磁場或電場等外力提高靶向效率,但對通過宿主-客體或配體-受體化學進行主動靶向的重視相對有限。外部刺激,如濃度或溫度的梯度擴散,也有望誘導靶向遞送。然而,利用智能進行目標定位和貨物交付的“基于機器人”交付的例子很少。因此,人工智能的集成對于簡化機器人設計和加強基于機器人的交付策略的制造勢在必行。此外,機器學習可以刺激配體的設計和篩選,從而有效地促進靶向遞送。
其次,生產率提升領域帶來了巨大的機遇。盡管微流體技術(如并行或多層設備)取得了進步,但提高智能微膠囊的生產率仍然受到限制,特別是在實際領域,如由于廣泛的顆粒需求而提高石油采收率。此外,目前的高通量設備大多提高了單乳液模板微膠囊的生產率,但由于外殼材料的妥協,這在某種程度上受到了“智能”性能的限制。在工業應用文獻中,使用高通量設備生成多室微膠囊或微粒的例子很少。利用計算機科學和可訓練的統計模型,機器學習已成為基于設計參數預測液滴發生器性能和流型的關鍵工具。這種能力減少了昂貴的設計迭代,彌合了專家和最終用戶之間的知識差距。機器學習在自動化微流體設計、優化操作和促進生產系統的擴展方面顯示出巨大的潛力,從而實現高通量生產。
最后,為了提高加載效率,一種有前景的解決方案是將基于液滴的微流體技術與多種自組裝方法相結合,如超分子主客體化學。此外,目前對配備智能門的微膠囊的研究主要依賴于多步合成過程,這往往會影響封裝效率。或者,塊狀納米顆粒與微流體輔助乳化的結合在靶向遞送和定量釋放方面具有巨大的潛力。總體而言,制造具有主動靶向性能的智能微膠囊,可能被制成人工智能顆粒,設想了各種實際應用。
免責聲明:文章來源DOI https://doi.org/10.1039/D3LC00835E 以傳播知識、有益學習和研究為宗旨。轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除。
標簽: 微流控

