崔華:基于智能手機(jī)和微流控芯片建立的時(shí)間-空間-彩色多分辨化學(xué)發(fā)光成像免疫分析檢測(cè)系統(tǒng)

引語(yǔ)
化學(xué)發(fā)光(CL)是在沒(méi)有光源和光譜系統(tǒng)的情況下,化學(xué)反應(yīng)產(chǎn)生的光發(fā)射,其在信噪比、靈敏度和線性范圍方面有很大的優(yōu)勢(shì)。化學(xué)發(fā)光(CL)生物檢測(cè)已成為臨床診斷的主要技術(shù)之一。一般來(lái)說(shuō),單一的標(biāo)志物的檢測(cè)對(duì)于疾病的準(zhǔn)確診斷是不夠的。因此,多種生物標(biāo)志物的測(cè)定越來(lái)越受到人們的關(guān)注。如何在單個(gè)芯片上實(shí)現(xiàn)對(duì)多個(gè)標(biāo)記物的同時(shí)檢測(cè)和快速準(zhǔn)確診斷仍是一個(gè)巨大的挑戰(zhàn)。
本研究首次報(bào)道了獨(dú)特的時(shí)空彩色多分辨化學(xué)發(fā)光成像系統(tǒng)并用于多重免疫測(cè)定。該創(chuàng)新策略具有靈敏度高、選擇性強(qiáng)、操作簡(jiǎn)單、成本低等優(yōu)點(diǎn),避免了復(fù)雜的標(biāo)記過(guò)程和來(lái)自相鄰檢測(cè)區(qū)的干擾,這項(xiàng)工作為多路分析的時(shí)間-空間-彩色多分辨成像打開(kāi)了一扇門(mén)。
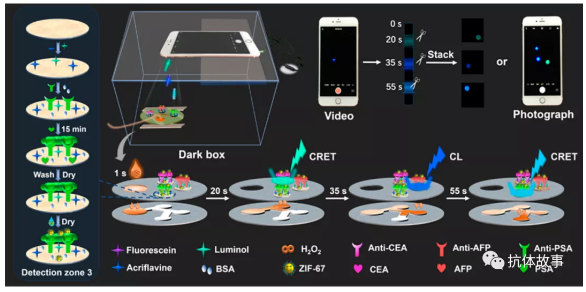
如示意圖所示,在雙層紙基微流控襯墊的頂層有注射區(qū),在毛細(xì)管力的驅(qū)動(dòng)下,可通過(guò)親水微通道自動(dòng)、有序地輸送反應(yīng)試劑到三個(gè)檢測(cè)區(qū)域。自動(dòng)觸發(fā)CL和共振能量轉(zhuǎn)移(CRET)反應(yīng),并由智能手機(jī)攝像頭記錄時(shí)間-空間-彩色多分辨CL成像信號(hào)。
成果簡(jiǎn)介
1. 時(shí)間-空間-彩色多分辨CL成像系統(tǒng)介紹。
如附件視頻S1所示,1號(hào)檢測(cè)區(qū)域信號(hào)為黃綠色發(fā)光,在20秒左右開(kāi)啟,在32秒關(guān)閉。2號(hào)檢測(cè)區(qū)域?yàn)樗{(lán)色發(fā)光,在35秒左右開(kāi)啟,在48秒左右關(guān)閉。3號(hào)檢測(cè)區(qū)為藍(lán)綠色發(fā)光,在55秒左右開(kāi)啟,在90秒左右關(guān)閉。由此得到了時(shí)空彩色多分辨閃爍型CL成像信號(hào)。由于相鄰探測(cè)區(qū)的光發(fā)射間隔時(shí)間較長(zhǎng)(大于2 s),采用時(shí)空分辨CL成像策略,相鄰光發(fā)射之間完全不存在干擾。魯米諾-雙氧水-ZIF-67體系的發(fā)光光譜在440 nm處表現(xiàn)出最大的發(fā)光波長(zhǎng)(圖S2),與熒光素和吖啶黃的激發(fā)波長(zhǎng)匹配良好,為實(shí)現(xiàn)CRET反應(yīng)提供了一個(gè)平臺(tái)。魯米諾-雙氧水-ZIF-67-熒光CRET體系的發(fā)光光譜在530 nm處表現(xiàn)出最大的發(fā)射波長(zhǎng)(圖S2),證明從LO22-*到熒光素(F2?*)的有效能量轉(zhuǎn)移,對(duì)應(yīng)于1號(hào)檢測(cè)區(qū)發(fā)射黃綠色光。魯米諾-雙氧水-ZIF-67-吖啶黃CRET體系的發(fā)光光譜在500 nm處表現(xiàn)出最大發(fā)射波長(zhǎng)(圖S2)。驗(yàn)證了從LO22-*到吖啶黃的有效能量轉(zhuǎn)移,形成3號(hào)檢測(cè)區(qū)藍(lán)綠色發(fā)光。
2.沸石咪唑酯骨架結(jié)構(gòu)材料ZIF-67用于檢測(cè)系統(tǒng)。
在沒(méi)有沸石咪唑酯骨架結(jié)構(gòu)材料ZIF-67的情況下,使用智能手機(jī)時(shí),光的發(fā)射相當(dāng)微弱,無(wú)法檢測(cè)到。利用ZIF-67作為催化劑,提高了魯米諾體系的電化學(xué)發(fā)光性能。在這個(gè)研究發(fā)現(xiàn),ZIF-67還可以增強(qiáng)魯米諾-雙氧水反應(yīng)的CL。TEM圖像和XRD結(jié)果(圖S3A,B)表明,ZIF-67顆粒為十二面體晶體結(jié)構(gòu),邊長(zhǎng)約200 nm。 ZIF-67的EDS結(jié)果(圖S3C)表明,ZIF-67的主要元素為C、N、Co,電感耦合等離子體質(zhì)譜(ICP-MS)測(cè)定的ZIF-67的Co含量為9.73%。ZIF-67納米結(jié)構(gòu)中原子分散的陽(yáng)離子可以促進(jìn)雙氧水的分解,生成高活性的羥基自由基(OH*)。OH*與魯米諾反應(yīng)生成魯米諾自由基。然后與O2反應(yīng)生成O2*-。最后,O2*-與魯米諾自由基反應(yīng)產(chǎn)生強(qiáng)CL發(fā)射。魯米諾-雙氧水-ZIF-67體系CL反應(yīng)的強(qiáng)度分別比魯米諾-雙氧水和魯米諾-雙氧水-Co(Ⅱ) 增強(qiáng)了50倍和3倍(圖S3D)。ZIF-67催化多色光發(fā)射的機(jī)理如圖S4所示。
3.時(shí)空彩色多分辨CL成像系統(tǒng)視頻檢測(cè)模式驗(yàn)證。
不同濃度CEA、AFP、PSA存在時(shí)三個(gè)檢測(cè)區(qū)域的疊加圖如圖2A-C所示。可見(jiàn),在CEA、AFP、PSA檢測(cè)區(qū)疊加的圖片中,分別記錄了1個(gè)黃綠色、1個(gè)藍(lán)色、1個(gè)藍(lán)綠色圓形光點(diǎn)。三個(gè)光斑的CL強(qiáng)度分別隨著CEA、AFP、PSA濃度的增加而逐漸降低。此外,如果用Co(Ⅱ)離子取代ZIF-67,光發(fā)射與相應(yīng)抗原的濃度關(guān)系不大。因此,ZIF-67是制造該免疫分析系統(tǒng)的關(guān)鍵。
以ZIF-67為主的CL免疫分析的可能機(jī)制如圖S5所示。在傳感界面上特異性免疫反應(yīng)形成的大免疫復(fù)合物阻礙了ZIF-67顆粒向紙基的運(yùn)輸,并在紙基ZIF-67催化劑和CL試劑之間形成蛋白型障礙,同時(shí)該免疫復(fù)合物可以阻斷自由基在CL和CRET反應(yīng)中的電子轉(zhuǎn)移,抑制了ZIF-67的催化作用,導(dǎo)致抗原依賴(lài)模式下的光發(fā)射明顯減少。通過(guò)計(jì)算每個(gè)光斑的灰度值,實(shí)現(xiàn)了CEA、AFP、PSA的定量。如圖2D-F所示,得到了三條線性校準(zhǔn)曲線。CEA的檢測(cè)回歸方程為ΔGray = 2.07 l0g C + 29.92, R2 = 0.9973,檢測(cè)范圍為1 pg/mL ~ 10 ug/mL。AFP的ΔGray = 4.19 logC+ 51.56, R20.9970,檢測(cè)范圍從10 pg/mL到0.2 ug/mL。PSA的ΔGray = 8.32 log C + 122.30, R2= 0.9985,檢測(cè)范圍為10 fg/mL到50 ng/mL。ΔGray通過(guò)空白灰度值與相應(yīng)抗原灰度值相減獲得,C為濃度(g/mL)。CEA、AFP 和 PSA的檢出限為0.2 pg/mL,3.2 pg/mL和 4.2 fg/mL.
4. 時(shí)空彩色多分辨CL成像系統(tǒng)照相檢測(cè)模式驗(yàn)證。
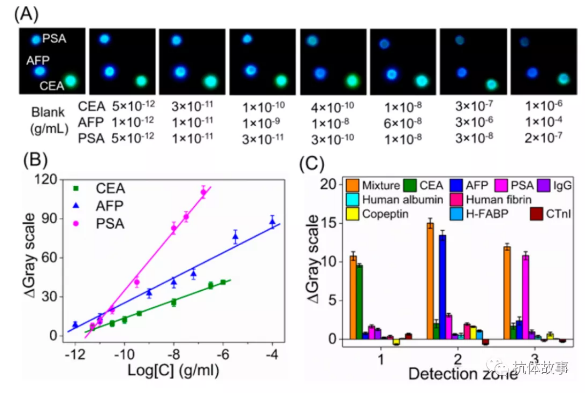
在2分鐘的曝光時(shí)間下在一張照片中記錄三個(gè)圓形且均勻的光斑,這些光斑與反應(yīng)相對(duì)應(yīng)(圖3)。不同濃度CEA、AFP、PSA的圖像如圖3A所示。空白緩沖液存在時(shí),三個(gè)光點(diǎn)非常強(qiáng),但隨著CEA(綠黃色光斑)、AFP(藍(lán)色光斑)和PSA(海藍(lán)寶石色光斑)濃度的增加,三個(gè)光點(diǎn)的強(qiáng)度逐漸減弱。如圖3B所示,得到了三條線性校準(zhǔn)曲線。CEA的ΔGray = 6.78 log C+81.54, R2 = 0.9962,檢測(cè)范圍為5 pg/mL ~ 1 ug/mL。AFP的ΔGray = 9.63 log C+ 121.62, R2= 0.9899, 檢測(cè)范圍為1 pg/mL ~ 100 ug/mL。PSA的ΔGray = 22.73 logC + 262.21, R2= 0.9969, 檢測(cè)范圍為5 pg/mL ~ 0.2 ug/mL。測(cè)定CEA、AFP、PSA的檢出限分別為2.1 pg/mL、0.4 pg/mL、3.9 pg/mL。在CEA、AFP和PSA檢測(cè)中,檢測(cè)范圍和檢測(cè)限優(yōu)于先前報(bào)道的CL μpad(表S1)。這種良好的敏感性主要?dú)w功于ZIF-67對(duì)CL和CRET反應(yīng)的巨大催化作用,以及本文提出的抗信號(hào)干擾策略。雖然照片檢測(cè)模式和視頻檢測(cè)模式有相似的成像性能和線性檢測(cè)范圍,但是照片檢測(cè)模式的發(fā)光強(qiáng)度的變化梯度與抗原濃度的變化(表示靈敏度)高于視頻檢測(cè)模式。而且照片檢測(cè)模式更簡(jiǎn)單、方便,對(duì)數(shù)據(jù)存儲(chǔ)和數(shù)據(jù)處理的要求更少。因此,對(duì)于時(shí)空彩色多分辨CL成像檢測(cè)來(lái)說(shuō),照片檢測(cè)模式是最佳的檢測(cè)模式。在智能手機(jī)上進(jìn)一步開(kāi)發(fā)了自編譯應(yīng)用程序(APP)以便用于智能檢測(cè)。
5. 照相檢測(cè)模式免疫試劑的選擇性研究。
采用免疫球蛋白G (IgG)、人白蛋白、人纖維蛋白、肽素、心臟型脂肪酸結(jié)合蛋白(H-FABP)、心肌鈣蛋白I (cTnI)等多種蛋白作為可能的干擾物。如圖3C所示,從檢測(cè)區(qū)域相應(yīng)抗原得到的ΔGray值與含有相應(yīng)抗原的混合物得到的ΔGray值具有可比性,而從非特異性抗原得到的ΔGray值信號(hào)非常微弱。結(jié)果表明,所建立的免疫分析方法具有較好的選擇性。相對(duì)標(biāo)準(zhǔn)差(RSD)為3.26% ~ 6.57%(表S2)。結(jié)果表明,該系統(tǒng)具有較高的檢測(cè)精度。通過(guò)測(cè)定人血清中的CEA、AFP和PSA,進(jìn)一步研究了所提出的免疫測(cè)定方法的實(shí)用性。得到滿意的回收率(92-108%)(表S3)。并對(duì)所制備的襯墊的貯存穩(wěn)定性進(jìn)行了研究。在4℃密封超過(guò)30天后,沒(méi)有觀察到明顯的信號(hào)變化,這表明儲(chǔ)存穩(wěn)定性是可以接受的。因此,所開(kāi)發(fā)的CL免疫測(cè)定法適用于臨床診斷。
圖文導(dǎo)讀
圖1 檢測(cè)視頻不同時(shí)間典型截圖的疊加圖像,圖像分別對(duì)應(yīng)檢測(cè)區(qū)域1(A)、2(B)、3(C)產(chǎn)生的光發(fā)射
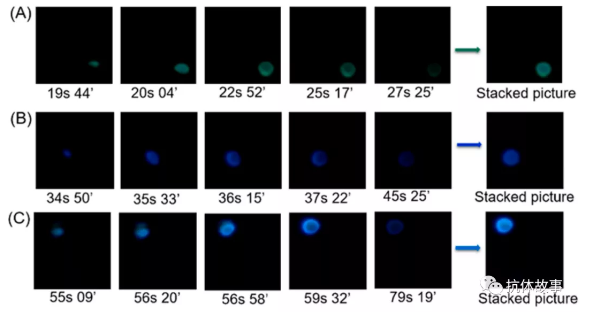
圖2 檢測(cè)區(qū)1(A)、2(B)和3(C)號(hào)在不同濃度的CEA、AFP和PSA存在時(shí)的堆疊圖片。CEA (D)、AFP (E)、PSA(F)為視頻檢測(cè)模式的代表性校準(zhǔn)曲線
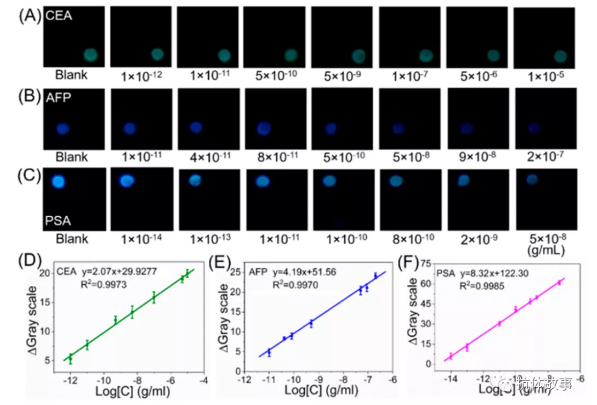
圖3 (A)檢測(cè)不同濃度CEA、AFP和PSA時(shí)的照片。(B)采用照片檢測(cè)模式進(jìn)行CEA、AFP和PSA檢測(cè)的典型校準(zhǔn)曲線。(C) CL免疫測(cè)定的干擾研究,分別設(shè)置十個(gè)干擾組。
小結(jié)
首次利用雙層紙基微流控與智能手機(jī)結(jié)合,開(kāi)發(fā)了用于多重免疫測(cè)定的時(shí)間-空間-彩色多分辨化學(xué)發(fā)光成像免疫分析檢測(cè)系統(tǒng)。雙層紙基微流控包括運(yùn)輸核心反應(yīng)物的底層和發(fā)生免疫反應(yīng)、CL反應(yīng)和CRET反應(yīng)的檢測(cè)區(qū)域的頂層。在不同檢測(cè)區(qū)的魯米諾、魯米諾-熒光素、魯米諾-吖啶黃結(jié)合特異性抗體進(jìn)行固定。加入抗原和ZIF-67后,雙氧水被依次運(yùn)送到不同的檢測(cè)區(qū)域。然后,利用智能手機(jī)作為便攜、方便的檢測(cè)設(shè)備,觸發(fā)ZIF-67催化魯米諾-雙氧水CL和CRET反應(yīng),產(chǎn)生時(shí)空彩色多分辨CL成像信號(hào)。同時(shí),開(kāi)發(fā)了一款在智能手機(jī)上運(yùn)行并用于智能檢測(cè)的應(yīng)用程序。CL成像檢測(cè)可采用視頻檢測(cè)模式或照片檢測(cè)模式進(jìn)行。作為概念驗(yàn)證,開(kāi)發(fā)免標(biāo)記的CL免疫測(cè)定法用于測(cè)定三種癌癥模型生物標(biāo)志物,包括CEA、AFP和PSA。時(shí)空彩色零分辨CL成像策略具有靈敏度高、選擇性好、簡(jiǎn)單、低成本等特點(diǎn),可以避免復(fù)雜的標(biāo)記程序和鄰近檢測(cè)區(qū)的干擾,可用于開(kāi)發(fā)各種免疫分析方法,在臨床診斷、食品安全評(píng)價(jià)、環(huán)境監(jiān)測(cè)等領(lǐng)域具有巨大的應(yīng)用潛力。
原文鏈接:
https://pubs.acs.org/doi/10.1021/acs.analchem.0c01405
免責(zé)聲明:文章來(lái)源抗體故事 以傳播知識(shí)、有益學(xué)習(xí)和研究為宗旨。 轉(zhuǎn)載僅供參考學(xué)習(xí)及傳遞有用信息,版權(quán)歸原作者所有,如侵犯權(quán)益,請(qǐng)聯(lián)系刪除。