用于藥物篩選的微流控細胞陣列芯片
摘要
細胞區域分布培養以及如何有效地對微流體進行操控是微流控陣列芯片在細胞藥物研究中的關鍵技術。本研究介紹了一種利用SU-8負性光刻膠模具和PDMS制作雙層結構的微流控細胞陣列芯片的方法,該芯片通過C型的壩結構將進樣細胞攔截在芯片的細胞培養的固定區域,鍵合雙層PDMS構成閥控制層,閥網絡的開關作用成功實現了芯片通道內微流體的操控,同時芯片設計了藥物濃度梯度網絡,產生6個不同濃度的藥物刺激細胞。通過對芯片3種共培養細胞活性的檢測和藥物伊立替康(CTP-11)對肝癌細胞的濃度梯度刺激等實驗結果驗證該芯片在細胞研究和藥物篩選等方面的可行性。
對大量化合物進行快速、高通量篩選、低試劑消耗和低成本是藥物篩選發展過程的研究目標。近幾年來出現快速、高效的高通量篩選被廣泛發展和應用,成為藥物篩選的主要技術手段之一,但其自身存在一些局限,如多孔板(通常為96孔板)消耗的試劑量大、樣品的分配和操作難度較大、設備昂貴等。而基于微加工技術的微流控芯片技術具有分析速度快、試劑消耗少、易于集成和高通量分析等諸多優點,可以克服高通量藥物篩選的限制,為基于細胞的藥物篩選、組織工程和生物傳感器提供新的研究平臺。
利用微流控技術,開發微流控陣列細胞芯片應用于高通量藥物篩選具有很多獨特的優勢。微流控芯片這個微小平臺可以集成256個或更多的細胞培養腔微陣列,改變常規細胞培養方法,實現細胞藥物篩選的高通量化,而且芯片微納升級體積大大減少了試劑消耗量,減低藥物篩選成本;微流控芯片設計二維或者三維的微結構區域可產生低剪切力,使多種化合物進入、混合,形成濃度梯度,觀察細胞對不同濃度藥物的反應,從而進行藥物對細胞的毒性分析;微流控芯片的集成化優勢非常明顯,在芯片內可以集成微閥、微泵和電極等器件,將藥物的合成分離富集、實驗細胞培養、藥物效果檢測等多個步驟集成到一塊芯片,實現藥物篩選的自動化分析。將微流控技術與細胞培養技術相結合,構建藥物篩選的細胞微系統平臺是目前的研究熱點。
細胞在芯片的區域分布以及如何實現微流體的操控以及對細胞進行藥物作用是微流控技術在細胞高通量藥物篩選的研究應用的關鍵和難點。因此本研究介紹一種用于藥物篩選的微流控細胞陣列芯片。采用微加工技術設計和制作該芯片,在芯片上制作獨特的培養腔陣列及其微通道,進行細胞的固定分布和共培養,并在芯片上設計藥物濃度梯度網絡,當藥物注入芯片時,得到不同濃度的藥物成分作用細胞。微流體的控制通過微閥網絡來實現,從而保證了培養腔不同細胞培養的相對獨立,保持藥物濃度梯度的穩定性。同時本研究進行了抗腫瘤藥物伊立替康(CTP-11)對肝癌細胞的藥物篩選實驗,通過實驗室自制的加熱平臺上實現對該芯片細胞活性和藥物作用的實時觀察和檢測。
1實驗部分
1.1 芯片的設計
本實驗設計的微流控細胞陣列芯片如圖1a所示,它有3層結構,上面一層是閥控制通道層,中間一層是流體通道層,下面一層是適合細胞貼壁的玻璃層(圖1b所示)。流體層包括藥物濃度梯度網絡、6×6細胞培養腔陣列以及進出樣管道。細胞培養腔陣列在縱橫二維是連通的,縱向通道可以同時進樣培養3種不同細胞,橫向通道可以進樣培養液和藥物。流體層的通道高為50μm,寬為100μm,每個培養腔為600μm×600μm,中間有一個半徑為200μm的C型壩結構,壩高45μm,寬50μm,該結構可以將細胞攔截在壩內,保證細胞在固定的區域生長,而培養基和藥物等液體可以自由流通;藥物梯度網絡包含2個進樣孔和5級濃度梯度通道,可產生6個不同濃度的藥物溶液。閥控制通道層有2組控制閥:橫向閥和縱向閥,通過閥的開關作用實現對下一層的細胞培養陣列橫向通道和縱向通道的液流控制。
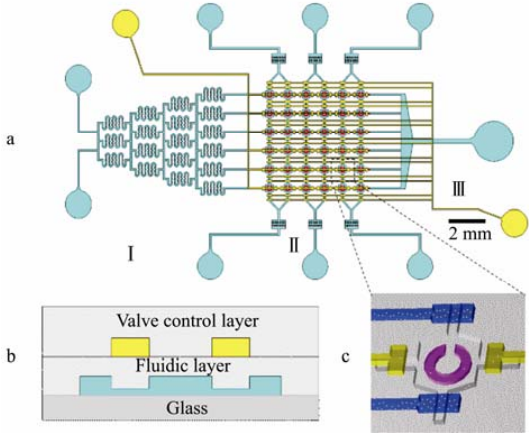
圖 1 微流控細胞陣列芯片設計示意圖
Fig. 1 Schematic illustration of microfluidic chip. (a) Schematic illustration of microfluidic chip. (b) Three layers of the microfluidic chip. (c) 3-D structure of a chamber containing row valves(yellow), column valves(blue) and C-shaped dam(red).
1.2 具有壩結構的三層微流控芯片的制作
該微流控芯片采用多次軟光刻技術以及模塑法制作,具體工藝流程如圖2所示。芯片制作的關鍵工藝是通過制作雙層的SU-8負性光刻膠的流體層模具形成壩結構以及熱鍵合法制作雙層的PDMS(聚二甲基硅氧烷)芯片。首先是利用“多次曝光、一次顯影”工藝制作SU-8膠雙層的芯片模具。在清洗干凈的硅片基底上甩涂稀釋的SU8-2025用SU8-2025與環戊酮按體積比100:53稀釋而成),厚約5μm,放在熱板上65oC烘1min,然后升溫至95oC保持2min,緩慢降溫至室溫,在光刻機上第1次曝光后,將硅片放到熱板上進行PEB,即65oC加熱烘1min,然后升溫到95oC保持2min,之后緩慢降至室溫,這樣第一層的圖形就轉移到SU-8光刻膠上。再將SU8-2050甩涂到基片上,完成前烘,將第二層掩模板與第一層光刻圖形對準,第二次曝光和后烘最后超聲輔助顯影就形成雙層圖形結構的SU-8模具。同理,完成單層的閥控制層SU-8模具的制作。
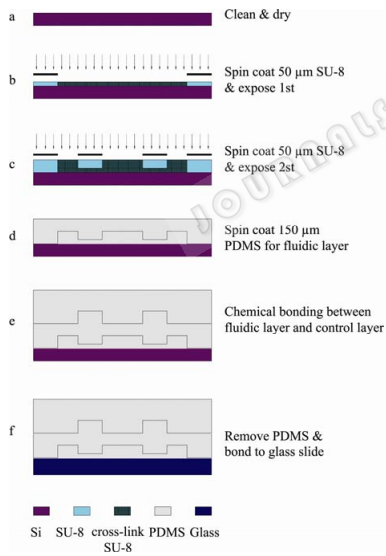
圖 2 微流控芯片的制作工藝流程 Fig. 2 Fabrication process for microfluidic chip.
為制作雙層的PDMS芯片,先將PDMS單體與固化劑按重量比20:1均勻混合,抽真空進行脫氣處理后,倒入流體層SU-8模具,在甩膠臺上轉速800r/min甩涂30s,然后放置在熱板上70oC加熱10min,形成150μm厚的PDMS薄層;接著調配單體與固化劑比為10:1的PDMS,真空脫氣處理后,澆注在閥控制層的SU-8模具中,厚為5mm,在熱板70oC加熱20min,冷卻后從硅片剝離,將剝離的閥控制PDMS層在顯微鏡下與流體層的PDMS薄層對準貼合,然后移至熱板上90oC加熱1h,完成雙層PDMS的熱化學鍵合反應,最后將雙層PDMS從硅片上剝離,打好孔并切割合適大小,與清洗干凈的玻璃片進行氧等離子鍵合,形成芯片通道的封閉,完成微流控雙層PDMS細胞陣列芯片的制作。
1.3 微流控芯片流體的操控
在芯片集成微閥以實現對芯片通道微流體的控制。微閥的結構是由上層閥控制層PDMS與下層流體層的PDMS薄膜構成。由于PDMS具有透氣性,不適合采用空氣閥,因此本實驗芯片采用液壓閥,即在閥通道內注入水或其他液體,通過注射器對閥通道的液體施加壓力(圖3b,P>0),下層的PDMS因楊氏模量小且厚度薄,易發生形變,阻擋下層的PDMS通道液體的流動,從而實現閥對通道的封閉效果;當壓力移除后(圖3a,P=0),PDMS薄膜恢復形變,恢復流體層通道的液體的流通。芯片的閥控制層有兩組閥:橫向閥和縱向閥。當多種細胞進樣時,橫向閥打開,縱向閥關閉,不同的細胞分別進入縱向的細胞培養腔,由于縱向閥阻隔了橫向通道的液體流動,各個縱向的細胞不會進入別的縱向細胞培養腔,從而實現多種細胞共培養(圖3c);當進行藥物實驗時,橫向閥關閉,縱向閥打開,藥物溶液可以保持穩定的濃度作用于橫向的不同細胞的培養腔(圖3d)。因此芯片兩組閥的操控可以進行對芯片通道內的微流體的控制,實現了芯片多種細胞的共培養和不同濃度的藥物分別對不同的細胞進行刺激的功能。
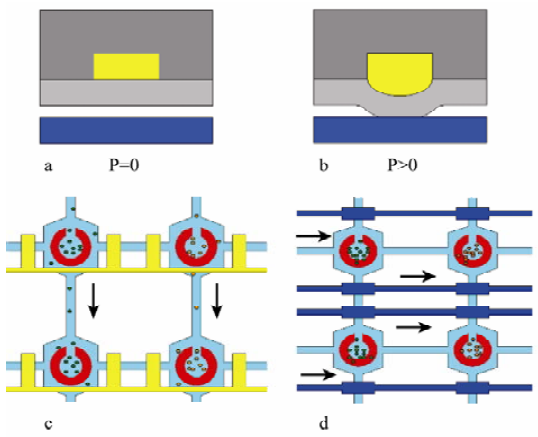
圖 3 微閥的結構圖和工作原理圖 Fig. 3 Structure and work mechanism of the microvalve.
1.4 微芯片細胞的培養
微流控細胞陣列芯片培養的細胞采用人肝癌細胞SMMC-7721、人肝正常細胞HL-7702和人臍靜脈內皮細胞HUVEC-2C。細胞培養液為RMPI1640,添加10%的胎牛血清和1%的鏈青雙抗,細胞消化液為0.25%的胰酶和0.02%的EDTA。
用聚合物管將制作好的芯片與帶有開關閥的注射器接連,接口處用粘接劑ELASTOSILE43密封。連接好的芯片通入75%乙醇,用紫外線照射1h,進行消毒處理。先用注射泵在芯片內通入細胞培養液2h,以排除芯片內殘余的乙醇和氣泡,有利于細胞在培養腔內貼壁生長。芯片移到實驗室自制的ITO玻璃加熱平臺,用連接開關閥的注射器對芯片的縱向閥加壓,然后將生長狀態良好的細胞從常規細胞培養皿中消化,吹打均勻,通過注射泵導入芯片的各縱列細胞培養腔,進行細胞培養。每24h通過注射泵更換一次細胞培養液,注射泵流速為0.2μL/s,進樣10min,以保證細胞培養時的營養更新和代謝物的排除。
1.5 微芯片細胞的藥物作用與檢測
芯片細胞培養72h后,關閉芯片的細胞進樣口和縱向閥,橫向閥加壓,芯片藥物梯度濃度網絡的一個進樣口注入含藥物CTP-11的培養液,另一個進樣口注入無藥物的培養液,2個進樣口的進樣速率為0.2μL/s,進樣10min。藥物作用細胞24h后,用PBS除去藥物溶液。
芯片內各個培養腔的細胞活性和藥物對細胞的作用是通過LIVE/DEADViability/CytotoxicityKit熒光試劑盒進行檢測。對芯片待檢測的細胞,先通入PBS清洗,再通入含2μmol/LCalceinAM和4μmol/Lethidiumhomodier-1的熒光染料混合液在室溫下孵育30min,然后在熒光顯微鏡下觀察并拍照,拍照的圖片用圖像分析軟件進行數據分析。
2結果與討論
2.1芯片的制作
通過微加工技術制作微流控芯片的模具可以由硅片、玻璃和SU-8負光刻膠等材料制作。SU-8負光刻膠可以制作高深寬比的厚膜圖形,以及它良好的力學性能和抗化學腐蝕性,而且它可以通過多次光刻形成臺階形多層結構復雜的圖形,這是硅片和玻璃等材料不能與之媲美的,因此基于SU-8負光刻膠加工模具的技術在微尺寸的微流控領域得到了廣泛應用。本實驗的芯片模具采用“兩次曝光,一次顯影”的方法制作雙層結構的SU-8模具,該方法簡便易行、經濟耐用。
本實驗中通過雙層PDMS與玻璃鍵合制作微流控細胞陣列芯片。PDMS是目前微流控技術中被廣泛采用的一種材料,由于其具有很好的透氣性,因此在PDMS芯片細胞生長時所需要的氧氣完全可以通過PDMS的通透性獲得,而不需要在培養液中溶解氧氣,且PDMS具有良好的透光性和生物相容性,有利于芯片內細胞培養和實時觀察。此外通過熱化學反應,兩層未完全固化的PDMS之間的界面發生交聯,完成兩層PDMS的鍵合,這種方法的粘合牢固,可以承受6×105帕以上的壓力。雙層PDMS構成控制閥,實現了對微流控芯片的流體的控制,增加了實驗芯片的功能和操控性。最終制成的微流控細胞陣列芯片如圖4所示,芯片只有一片普通載玻片的大小,芯片內通道的總體積約為5μL,在細胞藥物實驗中所需的培養液和藥物的消耗為微升數量級,這大大降低了藥物篩選的實驗成本。

圖 4 微流控細胞陣列芯片的實物圖 Fig. 4 Photograph of the final microfluidic cell culture array chip.
2.2藥物濃度梯度的表征
微流控芯片的藥物濃度梯度的形成機制是基于微通道的層流的擴散混合效應。細胞陣列芯片的藥物濃度梯度網絡具有5級濃度梯度通道,細胞培養液和含一定藥物濃度的細胞培養混合液通過注射泵和連接管以相同的流速分別從2個進樣口注入,液流先分為2支相同濃度的分流,其中相鄰的2支分流在通道中間混合、擴散,組合成新的濃度的液流進入下一級,在第二級通道網絡構成3種不同濃度的液流分支。這樣不同濃度的液流不斷地分流、混合、擴散,形成新的濃度的液流,芯片最終產生6個濃度梯度的細胞培養混合液。濃度梯度通道采用半徑為50μm的半圓波浪型通道,這樣的結構可以加強微流控通道的層流效應,可以使藥物濃度產生更好的混合效果。
實驗采用與藥物伊立替康分子量(677.19)相近的熒光染料羅丹明B代替藥物進行芯片的藥物濃度梯度的表征實驗。將含有1mmol/L羅丹明B的細胞培養液和純細胞培養液通過注射泵以0.2μL/min的相同流速從進樣口同時進入芯片濃度梯度網絡,2h后,濃度梯度網絡形成穩定的梯度濃度羅丹明B溶液,用熒光顯微鏡拍照6個管道的熒光圖片(圖5),用圖像分析軟件ImageProPlus6.0分析每個通道的相對熒光值(虛線上通道平均熒光值減去背景平均熒光值),從而得到6個通道的羅丹明B濃度(0、0.212、0.523、0.668、0.769和1.0mmol/L)。從實驗數據分析可知,芯片的藥物濃度梯度網絡可以產生6個具有一定線性的不同濃度藥物溶液同時進入細胞培養腔,刺激細胞。
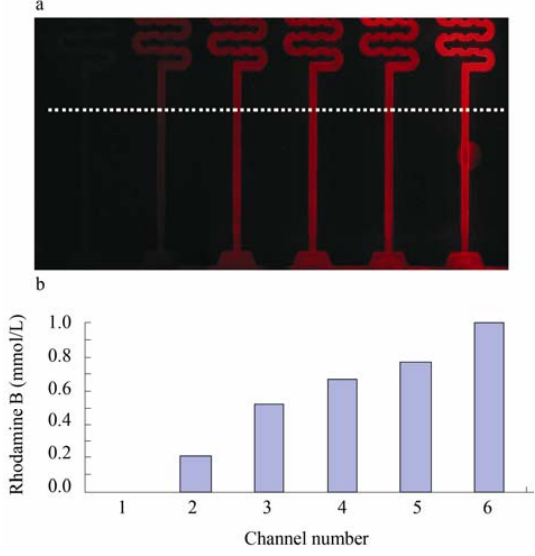
圖 5 芯片的羅丹明 B 藥物濃度梯度的表征 Fig. 5 Fluorescence micrograph showing six gradient concentrations of Rhodamine B.
2.3芯片細胞的進樣與培養
細胞進樣時在芯片內的分布是通過芯片培養腔的C型壩結構的物理攔截來實現的。壩頂部與玻璃層之間構成一個高度為5μm的狹縫,而細胞的直徑一般為10~20μm,因此,細胞進入培養腔,由于狹縫的攔截作用和微流體的流動,細胞只分布在培養腔的中心區域,即C型壩內,而其他區域的細胞會隨著流體流走,這樣細胞陣列芯片可以有效地控制進樣細胞的分布區域,以便觀察和分析。圖7a為細胞進樣時在培養腔的分布,進樣的細胞都被捕獲在壩的縫隙了,當壩的縫隙布滿了細胞后,細胞不再進入壩內,流向下一行的培養腔,這樣每一行的細胞進樣數目基本相同,這樣有利于提高細胞分析的可比性和準確性。因此芯片的壩結構對細胞具有很好的攔截作用,而且可以很好地模擬組織細胞培養生長的微環境。
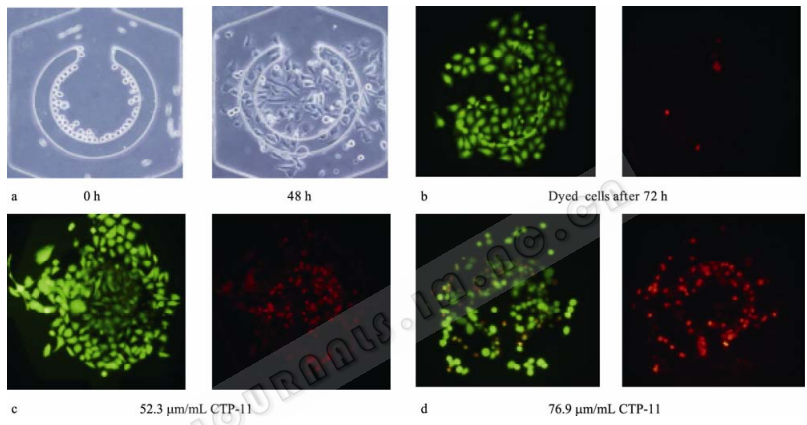
圖 7 細胞在芯片培養腔的培養、藥物作用與檢測 Fig. 7 Culturing, drug screening and detection of cells in the chip. (a) Cells growth in the chip after 0 h and 48 h. (b, c, d) Live and dead cells cells stained with Calcein AM and EthD-1 with 24 h treatment of 0, 52.3,76.9 μm/mLCTP-11.
三種細胞(癌細胞SMMC7721、正常肝細胞HL-7702和人臍靜脈內皮細胞HUVEC-2C)在芯片閥控制層的作用下分別進入不同列的細胞培養腔,待細胞貼壁后,除去閥作用,實現細胞的共培養。3種不同的細胞可以在物理上保持獨立性,同時可以通過液體流動保持彼此的聯系和相互作用,這樣的細胞共培養可以簡單實現一個生理組織(如肝癌組織)的體外模擬培養。圖7通過對芯片各個培養腔細胞的熒光照片進行分析,在芯片內3種細胞的活性都可在95%以上,表明了該芯片內的細胞的生長狀態良好,適宜進行相關的細胞研究。
2.4CTP-11對肝癌細胞的藥物篩選
從芯片藥物濃度梯度的表征實驗可知,當通入濃度為100μg/mL的CTP-11溶液,芯片可形成6個一定梯度的藥物濃度作用芯片培養的肝癌細胞(0、21.2、52.3、66.8、76.9和100μg/mL),細胞的活性分別為91.6%、84%、75.3%、66.1%、55.3%和37.4%(圖6)。因此不同濃度CTP-11作用細胞后,細胞生長活性受到不同程度的抑制,抑制作用隨藥物濃度的升高而增強。通過對熒光照片的分析,在不同藥物濃度作用下,可以發現凋亡過程中細胞的形態變化,如細胞體積縮小、細胞突起以及凋亡小體(圖7c、7d)。可見本實驗的微流控芯片通過一定的梯度濃度藥物刺激細胞,分析細胞對不同濃度藥物的毒性反應,研究藥物作用的機理,實現細胞藥物的篩選。
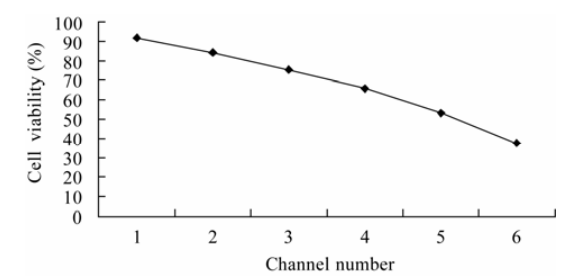
圖 6 不同濃度的 CTP-11 對肝癌細胞的活性檢測 Fig. 6 Viability of SMMC-7721 against six gradient concentrations of CTP-11 in the chip.
3結論
本研究通過對“多次曝光,一次顯影”SU-8工藝以及多層PDMS鍵合工藝的研究,設計并制作了具有高深寬比的雙層結構的SU-8光刻膠模具,制作了C型壩三維結構的細胞培養腔陣列,能夠很好地控制細胞在芯片內的生長分布,有效地解決陣列芯片細胞分布無序的難題。通過雙層PDMS鍵合將微閥器件集成到芯片上,通過對閥控制網絡的操控實現陣列芯片流體的控制。這些工藝的研究有效地解決了微流控芯片在基于細胞研究方面的一些關鍵問題。芯片還設計了藥物濃度梯度網絡,形成穩定的梯度藥物濃度,以便研究不同濃度藥物對細胞的毒性作用。這些實驗驗證了微流控細胞陣列芯片在實現細胞藥物篩選的高通量、低消耗低成本和快速高效等功能的可行性。因此,將微流控技術和細胞培養技術有機結合,可以實現多種細胞的固定培養和不同濃度藥物對不同細胞進行并行刺激,為了藥物篩選和細胞組織工程研究提供了一個理想的研究方法和平臺。
文獻來源:生物工程學報 作者:鄭允煥 吳建璋 邵建波等(轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除)