基于微流控芯片技術(shù)的CTC檢測(cè)新方法
近期,一項(xiàng)基于微流控芯片技術(shù)的CTC檢測(cè)新方法出現(xiàn),相關(guān)研究結(jié)果發(fā)表在國(guó)際化學(xué)領(lǐng)域頂級(jí)期刊《Angew Chem》上。《Angew Chem》是化學(xué)領(lǐng)域影響力最大的期刊之一,在業(yè)界享有極高的聲譽(yù)(2017,IF=11.994)。
循環(huán)腫瘤細(xì)胞(CTC,Circulating Tumor Cell),即腫瘤在生長(zhǎng)過程中,向血液循環(huán)中釋放的各類腫瘤細(xì)胞的總稱,是導(dǎo)致腫瘤擴(kuò)散的關(guān)鍵因素。
CTC從腫瘤病灶脫離后進(jìn)入外周血隨血液流動(dòng),沿著血流方向來尋找合適的“土壤”來生長(zhǎng),最后要么被毛細(xì)血管截留或者粘附在血管壁上,要么就在外周血中循環(huán)最后被清除,只有極少數(shù)目的 CTC能附著在血管壁上,重新穿過血管,到達(dá)新的“土壤”,適應(yīng)環(huán)境后成長(zhǎng)為新的腫瘤。
CTC是一種生物標(biāo)志物(biomarker),這是目前臨床研發(fā)與應(yīng)用的重點(diǎn),是被寄希望用于癌癥預(yù)后、分期診斷、療效監(jiān)控、復(fù)發(fā)預(yù)測(cè)、用藥指導(dǎo)、早期檢測(cè)等的標(biāo)志物。與經(jīng)典組織活檢相比,具有腫瘤分子信息全、侵入性小、取樣方便、成本低等優(yōu)勢(shì)。
CTC檢測(cè)的最大困難在于其在外周血中含量稀少,通常1 mL外周血中含有109個(gè)紅細(xì)胞,106個(gè)白細(xì)胞,而可能只含有1-10個(gè)CTC,在如此龐大復(fù)雜的正常細(xì)胞背景干擾下,比如巨核細(xì)胞、內(nèi)皮細(xì)胞,未成熟的造血細(xì)胞,上皮細(xì)胞等,很難實(shí)現(xiàn)高靈敏、高特異的CTC 捕獲檢測(cè)。
盡管目前市場(chǎng)有各種各樣用于分離及檢測(cè)CTC技術(shù),但由于缺乏必要的敏感性,它們的臨床應(yīng)用并不被廣泛采用,大多數(shù)技術(shù)往往受到捕捉性的限制,在捕獲的高效率與高純度之間難以進(jìn)行權(quán)衡。現(xiàn)在已經(jīng)使用的微型柱和人字形結(jié)構(gòu)成功的證明可以增加細(xì)胞和免疫表面相互作用,提高捕獲效率,可遺憾的是,這種增強(qiáng)的相互作用是非選擇性的,與非靶細(xì)胞相互作用的均等性機(jī)會(huì)將導(dǎo)致最后捕獲的CTC純度并不是很高。
Now,我們來了解這款新的CTC捕獲設(shè)備及方法:SDI-Chip,Size Dictated Immunocapture Chip,基于尺寸大小的免疫捕獲芯片技術(shù)。該項(xiàng)技術(shù)檢測(cè)CTC擁有更高的靈敏度、特異性及空間分辨率,SDI-Chip具有一定的選擇性,采用表面具有流體動(dòng)力優(yōu)化的免疫涂層微米柱,頻繁的互動(dòng)及擴(kuò)展來捕獲CTCs。不同抗原表達(dá)水平的CTC可以的有效地被微米柱所捕獲;在血樣中,CTC的捕獲效率大于92%,純度達(dá)到了82%,此次研究對(duì)象為非轉(zhuǎn)移的結(jié)直腸癌(CRC)患者。
研究者開發(fā)的基于流體力學(xué)分離與免疫識(shí)別的CTC捕獲富集芯片(SDI-Chip)技術(shù),其內(nèi)構(gòu)建了成千上萬個(gè)表面修飾有抗體的微柱陣列,微柱陣列排布方式根據(jù)確定性側(cè)向位移分離原理設(shè)計(jì),CTC因尺寸較大將沿微柱偏移方向運(yùn)動(dòng)并不斷與微柱碰撞而實(shí)現(xiàn)特異性識(shí)別捕獲,而血細(xì)胞因尺寸較小將沿液流方向運(yùn)動(dòng)且很少與微柱碰撞而避免非特異性吸附。該設(shè)計(jì)有效地結(jié)合CTC在物理性質(zhì)及表面標(biāo)志物與背景細(xì)胞的差異,實(shí)現(xiàn)了CTC的高效、高純度協(xié)同捕獲。通過對(duì)大量臨床腫瘤病人外周血樣品的測(cè)試,該研究者驗(yàn)證了所發(fā)展的芯片技術(shù)在腫瘤分期診斷、療效監(jiān)控等方面的潛在應(yīng)用價(jià)值。

SDI-Chip由兩個(gè)鏡像一樣的包被上皮細(xì)胞粘附分子抗體(EpCAM)的微柱陣列組成,中間有一個(gè)樣品入口,并有上下兩個(gè)緩沖區(qū)入口(圖1)。
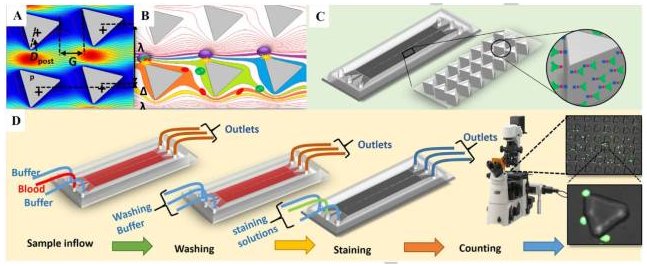
通過計(jì)算流體動(dòng)力學(xué)(CFD)用于對(duì)不同幾何形狀進(jìn)行排序,并進(jìn)一步優(yōu)化微柱的布置,與圓形和橢圓形微柱相比,三角形微柱提供更高的相互作用概率和較低的剪切應(yīng)力(圖2)。
為了可視化流動(dòng)模式和細(xì)胞與微柱的相互作用,研究者開發(fā)了一個(gè)模擬將CFD與固體力學(xué)相結(jié)合的模型,將不同尺寸的球形顆通過路上的微柱,然后粒泵送到出口,見圖3及視頻1:
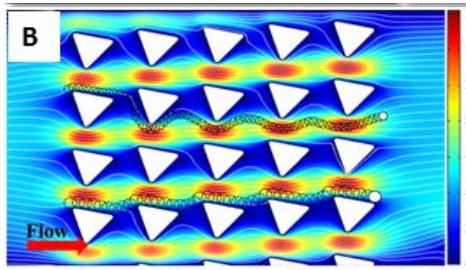
大于臨界直徑(Dc,13μm)的顆粒在與之相互作用的過程中被迫偏轉(zhuǎn)離并交叉流線于微柱。由于每一列微柱被安排的與上一行偏離,大顆粒不斷與每一個(gè)微柱相互作用,導(dǎo)致流動(dòng)形成了偏斜角。相比之下,小于Dc的粒子仍然以原始流線運(yùn)行,并減少與微柱的相互作用。模擬結(jié)果使用聚苯乙烯(PS)珠證實(shí)了實(shí)驗(yàn)觀察到相同的流動(dòng)模式,見圖4及視頻2:
總體而言,發(fā)現(xiàn)了20μm微粒的相互作用概率大于95%,10um微粒相比有顯著提高,相互作用僅有5.5%。結(jié)果證明,SDI-Chip可以選擇性地增強(qiáng)大顆粒與微柱相互作用。由于CTC的大小通常大于血細(xì)胞,這樣的大小選擇性相互作用可以高效率和高純度的免疫捕獲CTC。
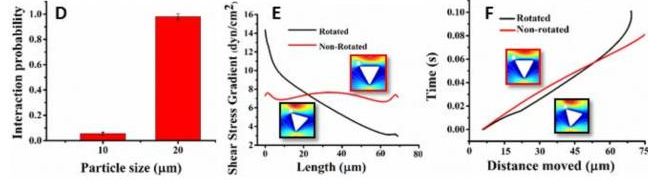
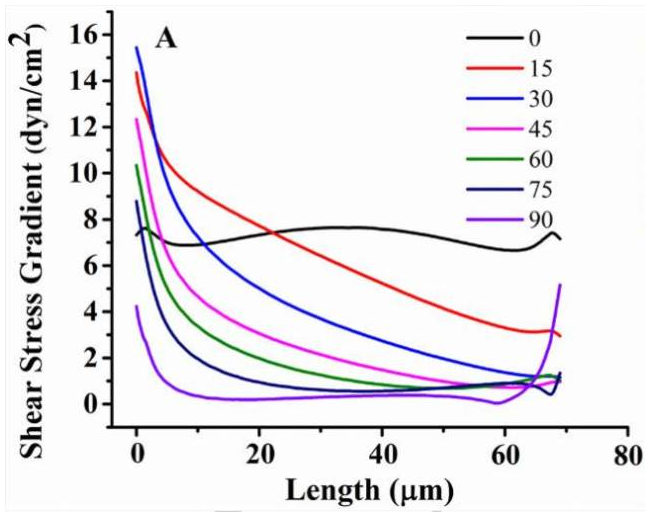
圖5E.以順時(shí)針旋轉(zhuǎn)一個(gè)三角形的微柱,到15o在它的軸線周圍提供了一個(gè)更光滑的水動(dòng)力梯度不影響細(xì)胞流動(dòng)模式的力量。
圖5F. 由于流體的影響,水動(dòng)力的梯度下降與旋轉(zhuǎn)的三角形微柱的斜坡相互作用產(chǎn)生增加了粘附力的梯度。因此,每個(gè)相互作用,ctc遷移到一個(gè)水動(dòng)力區(qū)域減小梯度,致使流速減小,導(dǎo)致與免疫組織微量柱接觸的持續(xù)時(shí)間延長(zhǎng)。
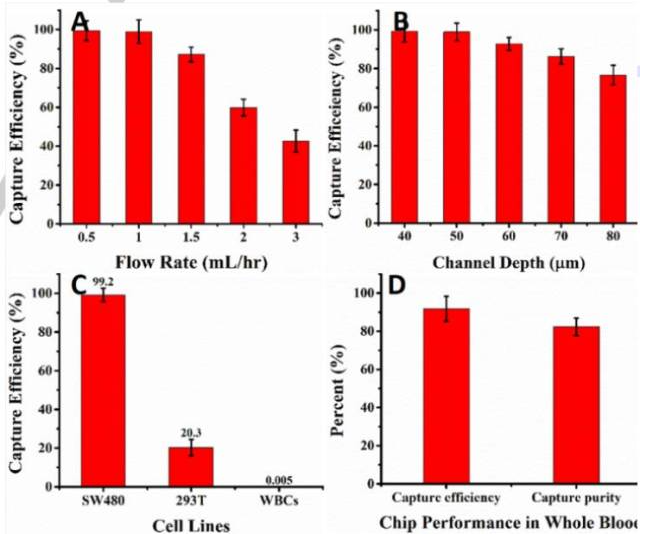
SDI – Chip進(jìn)行了傳統(tǒng)軟光刻技術(shù)優(yōu)化,后表面改性,抗體固定化和濃度優(yōu)化,捕獲芯片的性能驗(yàn)證使用了EpCAM-陽性SW480懸浮液細(xì)胞作為靶細(xì)胞(1000細(xì)胞/ml),293T細(xì)胞(EpCAM-陰性/罕見表達(dá)EpCAM)的懸浮液細(xì)胞和白細(xì)胞(WBCs)(106細(xì)胞/ml)作為對(duì)照細(xì)胞,通過50μm的最佳通道深度和流量為1ml/h的設(shè)備進(jìn)行檢測(cè)。
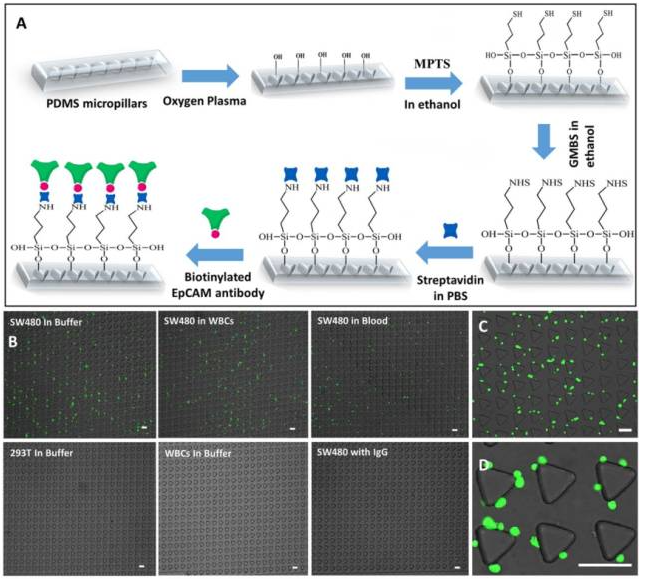
圖7. (A)表面化學(xué)改性和EpCAM抗體固定過程的示意圖。(B)顯微照相熒光標(biāo)記靶(SW480)細(xì)胞在緩沖或血液中分散,對(duì)照細(xì)胞(293T和WBCs)與免疫球蛋白SDI-Chip的結(jié)合。(C)和(D)顯微攝影顯示熒光標(biāo)記SW480細(xì)胞的近視野。(規(guī)模:100μm)。
通過在Buffer中摻入SW480細(xì)胞,SDI– Chip的捕獲效率為99.2±3.5%,純度為92.4±4.6%(圖8C),同時(shí)研究者也展示了SDI芯片的臨床潛力,使用血液樣品進(jìn)行細(xì)胞的捕獲實(shí)驗(yàn),通過將1000個(gè)SW480細(xì)胞加入1mL健康血液中來制備供體的血液。平均捕獲效率和純度分別為92.2±6.4%和82.3±3.8%(圖8D)。如此高的捕獲效率和純度是歸因于基于DLD原理的免疫接種相互作用。此外,具有由旋轉(zhuǎn)提供的流體動(dòng)力的梯度,在微柱表面上延長(zhǎng)接觸時(shí)間,三角形微柱也被認(rèn)為有助于提高捕獲效率。此外,靶細(xì)胞等血液細(xì)胞流向芯片的空間不同的區(qū)域,這可以減少目標(biāo)細(xì)胞的競(jìng)爭(zhēng)性脫落并確保在高細(xì)胞背景下存在高捕獲效率。
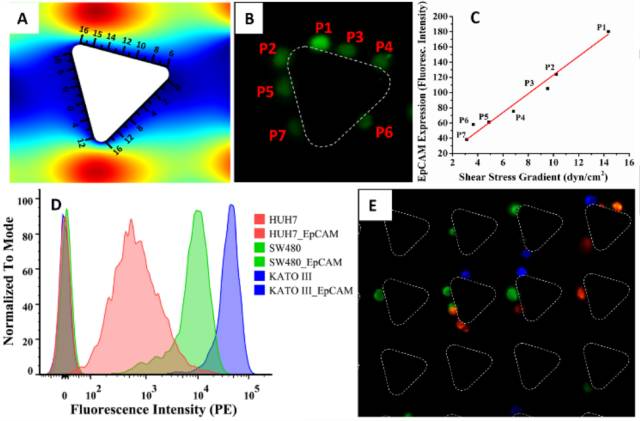
剪切力的流體動(dòng)力學(xué)梯度圍繞旋轉(zhuǎn)的三角形微柱產(chǎn)生(圖9A)允許根據(jù)其抗原來描述捕獲CTC微柱周圍的表達(dá)水平。細(xì)胞表達(dá)較高表面抗原量的CTC形成較強(qiáng)可以抵抗由于剪切而產(chǎn)生的移動(dòng)力的結(jié)合,并且被捕獲在三角形微柱的頂端附近。另一方面,表達(dá)細(xì)胞表面抗原相對(duì)較少量的CTC不會(huì)形成足夠強(qiáng)的抵抗力脫落力,因此,他們將沿著斜坡向下移動(dòng)(較低的剪切應(yīng)力面積),直到它們形成足夠牢固的粘結(jié)以抵抗該地區(qū)的流體動(dòng)力。
捕獲的SW480細(xì)胞使用微透鏡觀察使用熒光標(biāo)記的EpCAM抗體染色的CTC,來評(píng)價(jià)EpCAM表達(dá)水平熒光強(qiáng)度(圖9B)。與低細(xì)胞的熒光強(qiáng)度相比,熒光強(qiáng)度較高的細(xì)胞被發(fā)現(xiàn)被捕獲在剪切應(yīng)力的區(qū)域相對(duì)較高。這樣的空間解決捕獲使我們能夠評(píng)估在芯片中捕獲的CTC的抗原表達(dá)水平,通過觀察CTC圍繞微柱的捕獲位置及抗原進(jìn)行其他下游分析。
在SDI- Chip的免疫染色后,采集CTC和白細(xì)胞的樣品顯微圖(圖10):
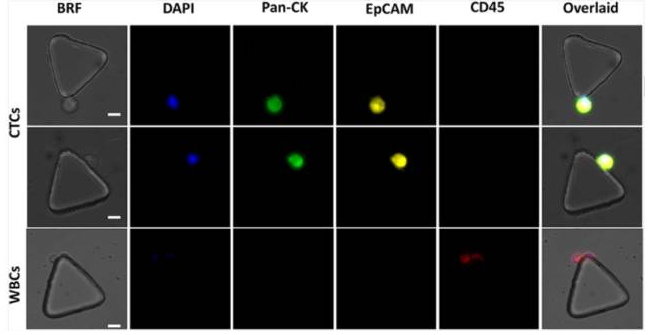
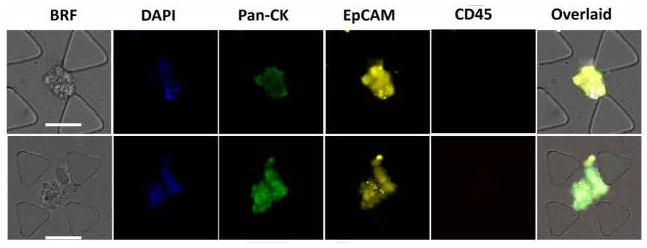
用EpCAM、CK、CD45抗體、DAPI對(duì)SDI- Chip進(jìn)行免疫染色后,采集CTC集群的樣品顯微攝影(圖11):
作為一款新的CTC捕獲技術(shù),怎么能不跟行業(yè)的標(biāo)桿CellSearch?進(jìn)行比對(duì)呢!(雖然CellSearch的缺點(diǎn)很多人都知道,但是它畢竟是行業(yè)內(nèi)第一款獲批的CTC產(chǎn)品啊!)
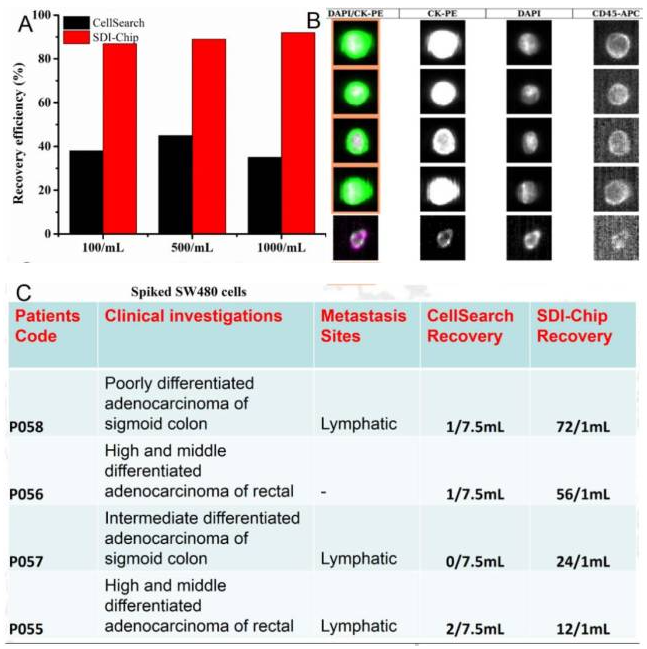
通過比較SDI-Chip與CellSearch?可以發(fā)現(xiàn):SDI-Chip的CTC檢出率明顯高于CellSearch?,達(dá)到近乎90%的檢出率,關(guān)鍵人家使用的是1ml血哦(圖12)。
(A)在健康血液樣本中使用SW480細(xì)胞的回收率比較。
(B)CellSearch成像結(jié)果。
(C)利用SDI-Chip和CellSearch對(duì)CRC病人的臨床發(fā)現(xiàn)及回收細(xì)胞數(shù)量比較。
國(guó)內(nèi)液體活檢產(chǎn)業(yè)正在如火如荼的蓬勃發(fā)展,各種技術(shù)都在日新月異的變化,無疑會(huì)帶來更多市場(chǎng)格局的變化,從研究到臨床轉(zhuǎn)化研究再到臨床應(yīng)用,是一個(gè)漫長(zhǎng)而嚴(yán)謹(jǐn)?shù)牡缆罚M?/span>CTC技術(shù)能夠早日成熟,造福于更多的腫瘤患者!
免責(zé)聲明:文章來源網(wǎng)絡(luò) 以傳播知識(shí)、有益學(xué)習(xí)和研究為宗旨。 轉(zhuǎn)載僅供參考學(xué)習(xí)及傳遞有用信息,版權(quán)歸原作者所有,如侵犯權(quán)益,請(qǐng)聯(lián)系刪除。
標(biāo)簽: 微流控芯片