肺器官芯片的歷史、起源和發(fā)展
1. 介紹肺器官芯片微流控系統(tǒng)的發(fā)展歷史
人的肺在呼吸系統(tǒng)中起著氣體交換的重要作用。它們的海綿狀結(jié)構(gòu)以肺泡亞單位的形式最大限度地增加了有用的表面積,在肺泡亞單位中,吸入的空氣和穿過一層薄薄的細胞膜的血管系統(tǒng)之間存在著氣液界面(ALI)。這種ALI是理解肺行為和病理的一個非常有趣的特征,因為正是在這里,異物和病原體經(jīng)常首先接觸到身體。
雖然許多動物模型已被用于研究肺部疾病(Cardoso,2001;Matute-Bello等人,2008;Morrisey和Hogan,2010),但它們與人類系統(tǒng)缺乏足夠的相似性,在基于動物的平臺上留下了可能的空白。80%通過臨床前動物試驗的藥物實際上并不能有效地治療人類預(yù)期的目標疾病,這一事實證明了這一點(Perrin,2014)。一個被稱為“埃羅姆定律”的趨勢描述了自1950年以來,美國食品和藥物管理局每百萬美元用于藥物研發(fā)的批準藥物數(shù)量如何每9年減少一半(Scanell等人,2012年)。這鮮明地提醒人們,生物學研究面臨著越來越大的挑戰(zhàn),迫切需要改進方法。因此,使用人類細胞的體外平臺已成為動物模型的必要補充,如果不是替代的話,它除了帶來更高的生物相似性之外,還帶來了許多好處,例如高通量篩選的潛力、成本效益以及解決圍繞動物試驗的倫理問題。
然而,盡管有這些優(yōu)點,從體內(nèi)(動物)系統(tǒng)到體外系統(tǒng)的過渡也有明顯的缺點,其中最顯著的是細胞環(huán)境中復雜性的喪失。定義細胞發(fā)育和器官水平功能的生物力學線索是高度多方面的,很難在相對簡單的二維格式細胞培養(yǎng)上完全概括(Huh等人,2011年)。此外,僅從兩個維度研究細胞的事實就限制了與活體人類細胞的相似性。這些因素推動了3D細胞培養(yǎng)的發(fā)展,允許通過各種材料同時培養(yǎng)多種類型的細胞,以模擬體內(nèi)的細胞外基質(zhì)(ECM)(Kim和Rajagopalan,2010)。隨著微流控技術(shù)和設(shè)備的最新進展,3D細胞培養(yǎng)方法可以用一系列通用的技術(shù)來擴充,甚至可以進一步概括體外器官水平的功能。這些措施包括連續(xù)灌流培養(yǎng)液和對培養(yǎng)細胞施加可控的流體和固體機械應(yīng)力,以重建體內(nèi)的生物化學和生物力學微環(huán)境。從這種融合中誕生的設(shè)備被稱為芯片上的器官,并呈現(xiàn)出巨大的潛力,將徹底改變?nèi)祟惒±韺W的研究方式。要全面了解芯片上器官的總體情況,請單擊此處。微流體帶來的微流體能力對于肺的重現(xiàn)特別有趣,肺表現(xiàn)出高度機械的環(huán)境,尤其是因為呼吸導致組織拉伸時施加在細胞上的力。在這篇簡短的綜述中,我們從微流控設(shè)計和實現(xiàn)的角度討論了單芯片肺平臺的起源和發(fā)展。
2. 開創(chuàng)性的“芯片肺”
2010年,Huh展示了一種開創(chuàng)性的微流控設(shè)備,該設(shè)備此后定義了芯片肺平臺的發(fā)展方向(Huh等人,2010年)。在這里,我們將討論包含的創(chuàng)新設(shè)計特征,并簡要描述它是如何用于研究肺部行為的。該器件(圖1)由三層PDMS層組成:兩層具有平行的微圖案化通道,在其間然后是一層薄的多孔膜層。這種膜形成了兩室膜分離系統(tǒng)。細胞外基質(zhì)被插入到腔室中,以覆蓋膜的兩側(cè),以便隨后的細胞附著。在膜的一側(cè)種植肺泡上皮細胞,另一側(cè)種植血管內(nèi)皮細胞。接下來,通過讓空氣通過上皮側(cè)腔室,基本上模仿了在人類肺泡中發(fā)現(xiàn)的結(jié)構(gòu)和細胞組成,建立了ALI。雖然以前已經(jīng)展示了重建這種肺泡屏障的系統(tǒng),例如使用Transwell裝置(Yamaya等人,2002年),但過去的裝置不能重建存在于該膜上的機械環(huán)境。HH的設(shè)備通過創(chuàng)新地使用與內(nèi)皮和上皮通道平行的兩個橫向通道實現(xiàn)了這種機械刺激。通過對這些側(cè)通道施加真空,柔性的PDMS可以變形,以實現(xiàn)以生理上相似的幅度和頻率對細胞內(nèi)襯的人工牙槽膜進行受控的循環(huán)拉伸。這種膜的拉伸是在細胞培養(yǎng)過程中進行的,并誘導上皮細胞層的仿生排列。
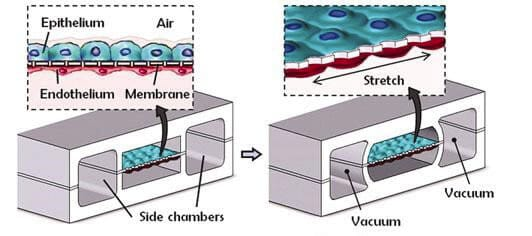
圖1:機械主動片上肺裝置。三層PDMS裝置由兩個中央腔室組成,由一層薄薄的多孔膜隔開,一邊種植肺泡上皮細胞,另一邊種植血管內(nèi)皮細胞。氣液界面是通過在上肺泡通道中流動空氣來建立的。如圖所示,可以對側(cè)室施加真空,以使彈性PDMS壁變形,從而使膜變形。這起到單向拉伸細胞的作用,并模擬人體肺泡擴張和收縮過程中所經(jīng)歷的拉伸。
從免疫學的角度研究了機械刺激對肺泡細胞行為的影響,以確定機械應(yīng)變是否改變了肺泡細胞的行為。一種炎性細胞因子(腫瘤壞死因子-α,或腫瘤壞死因子-α)被引入血管通道(即膜內(nèi)皮側(cè)的通道)。通過測量細胞間黏附分子-1(ICAM-1)的內(nèi)皮表達,該小組可以監(jiān)測在有和沒有機械驅(qū)動膜的情況下免疫炎癥反應(yīng)的差異。在這一點上,免疫反應(yīng)沒有可測量的差異。然而,在研究炎癥納米粒對LOC的反應(yīng)時,膜拉伸成為一個重要因素。為了模擬納米顆粒的吸入,將空氣傳播納米毒性研究中常用的納米硅顆粒(Napierska等人,2009年)引入設(shè)備的肺泡通道(即膜上皮側(cè)的通道)。在這種情況下,根據(jù)膜是否經(jīng)歷周期性、模擬呼吸、拉伸,免疫反應(yīng)有明顯的差異。在這種機械驅(qū)動下,觀察到免疫反應(yīng)增加,這也是用ICAM-1水平來確定的,以及與沒有拉伸的設(shè)備中測量的相比,納米顆粒的跨膜遷移增加。這些趨勢與在小鼠身上發(fā)現(xiàn)的納米顆粒反應(yīng)以及長期以來關(guān)于納米顆粒與肺相互作用的毒性效應(yīng)的研究是一致的。
3. 進一步開發(fā)肺器官芯片
這項關(guān)鍵性工作由Huh等人完成,自那以后確定了機械主動LOC平臺的方向。在這里,我們簡要討論一些其他的工作,這些工作是基于相同的技術(shù)重建細胞襯里的膜,如上所述,以及它們?nèi)绾伪挥糜诟鞣N生物學研究。
第一種,在2007年由Huh等人提出。實際上是上述裝置的前身,但值得討論的是它使用微流控工程來實現(xiàn)不同的結(jié)果。該裝置(圖2)(Huh等人,2007年)展示了相同類型的細胞線膜分離室,其中一個是“肺泡”充氣室,另一個是“血管”細胞介質(zhì)充填室。雖然在這個模型中沒有周期性的膜拉伸,但研究小組研究了液體塞流的影響,液體塞流是一種生理現(xiàn)象,在COPD、哮喘、肺水腫和毛細支氣管炎等疾病中,隨著病理性粘液塞的傳播而發(fā)生(Cassidy等人,1999年)。使用這些微流體產(chǎn)生的液體塞子,研究小組能夠重建潛在的上皮細胞損傷,并更好地了解和聲學檢測方法。
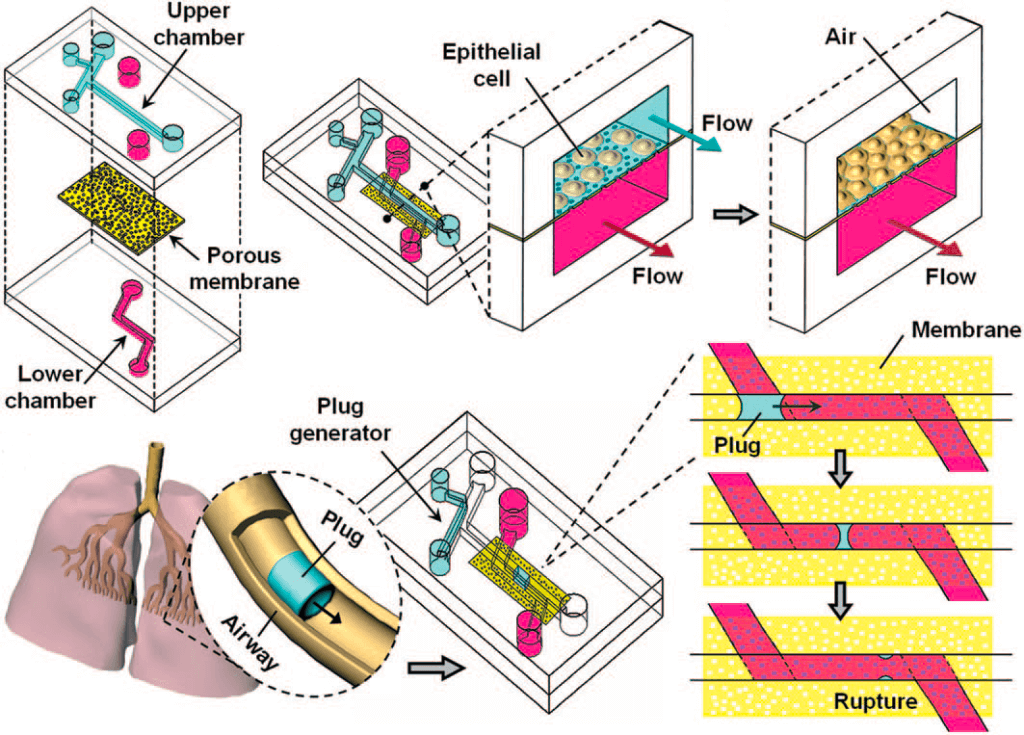
圖2:液體插頭肺器官芯片模型。利用一種特殊的微流體通道幾何結(jié)構(gòu),液體塞可以產(chǎn)生并在多孔膜上的一層上皮細胞上繁殖。
雖然肺泡是更多研究和理解的重要部位,但它們只代表整個呼吸系統(tǒng)的一個部分。相反,Benam等人的設(shè)備在微流控芯片上重建了小氣道,這是肺中最小的傳導路徑(Benam等人,2015)。該裝置(圖3)還具有種植細胞的薄多孔膜,但關(guān)鍵的區(qū)別在于所選擇的細胞類型-細支氣管上皮細胞而不是肺泡上皮細胞。他們能夠研究小氣道對細菌和病毒的免疫反應(yīng),并很好地展示了這種膜分離型LOC設(shè)備的多功能性。
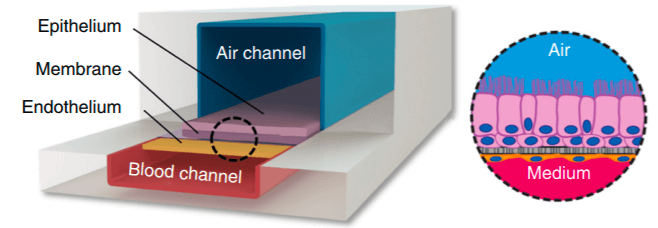
圖3:小氣道單芯片肺模型,利用種植在“空氣通道”中微孔膜上的細支氣管上皮細胞,相對“血液通道”中的一層內(nèi)皮細胞。
標簽: 微流控芯片