基于三維石墨烯仿生界面的微流控芯片
癌癥已經成為全世界面臨的重要問題。通常癌細胞與正常細胞在貼附、遷移、增殖等階段有區別,可在細胞的電阻抗特性上得到反映。同時,單細胞分析為研究細胞的特異性行為提供了獨特視角。傳統的細胞阻抗傳感器(electriccell-substrate impedance sensing (ECIS))由于細胞和電極材料是二維的接觸,而且表面相互作用弱,造成單細胞的電阻抗信號微弱,不能有效的監測單細胞的實時變化。
近日,浙江理工大學光電材料和器件中心在Biosensors and Bioelectronics上發表文章“Three-dimensionalgraphene biointerface with extremely high sensitivity to single cancer cell monitoring”(如圖1)。該文從仿生的角度,通過微納加工工藝和化學修飾相結合的方法制備了一種基于三維石墨烯仿生界面細胞電阻抗傳感器的微流控芯片(如圖2和圖3),用于單細胞和雙細胞的電阻抗監測。捕獲微槽和單細胞的形狀、尺寸相匹配,并且修飾在微槽上的石墨烯膜均一而且連續,激光刻蝕后各個捕獲微槽之間的電信號不會互相關聯和干擾。細胞捕獲在石墨烯界面上如圖4所示,石墨烯界面和細胞之間發生包裹和擠壓效應,并簇生出一定數量的脊。由于石墨烯微槽表面仿生的微納尺度紋理和褶皺與細胞表面的絲狀偽足更加的匹配,這樣的異質性界面相互作用將會為細胞在電極表面的貼附以及電信號的傳導提供更多的接觸位點和更大的接觸力,通過三維陷阱效應和微納尺度異質性紋理相互作用將細胞阻抗傳感器的靈敏度大幅提高,與傳統的阻抗傳感器相比單細胞約提高100%、雙細胞約提高50%(如圖5),并通過理論計算得到驗證。同時,通過石墨烯納米界面可以實時的實現單細胞表面CCD形貌記錄和電阻抗信號的提取(如圖6)。這將為設計仿生的異質性界面用于細胞相關的癌癥研究提供新的思路和方法。
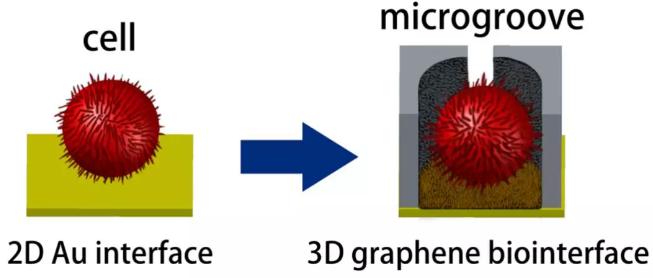
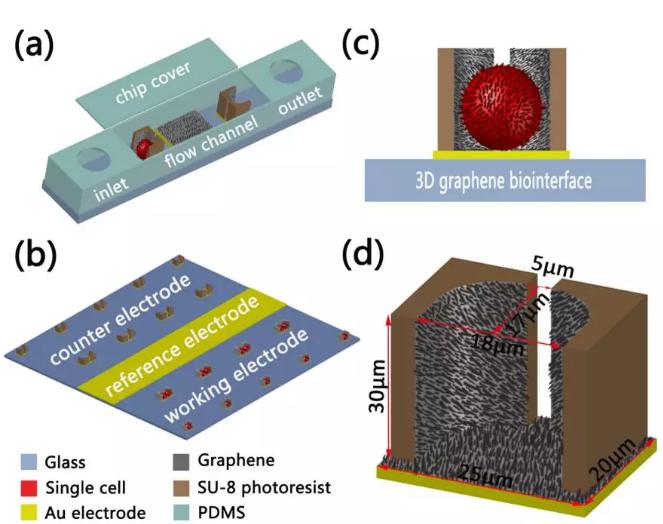
圖2三維石墨烯仿生界面細胞電阻抗傳感器基于的微流控芯片效果圖。(a)設計的微流控芯片三維圖,包括集成電極陣列、帶有入口和出口的PDMS流道以及PDMS蓋板;(b)捕獲區域的放大圖,包括不同尺寸電極相應的位置分布;(c)細胞捕獲在三維石墨烯仿生界面上的側視圖;(d)用于單細胞捕獲的石墨烯微槽尺寸
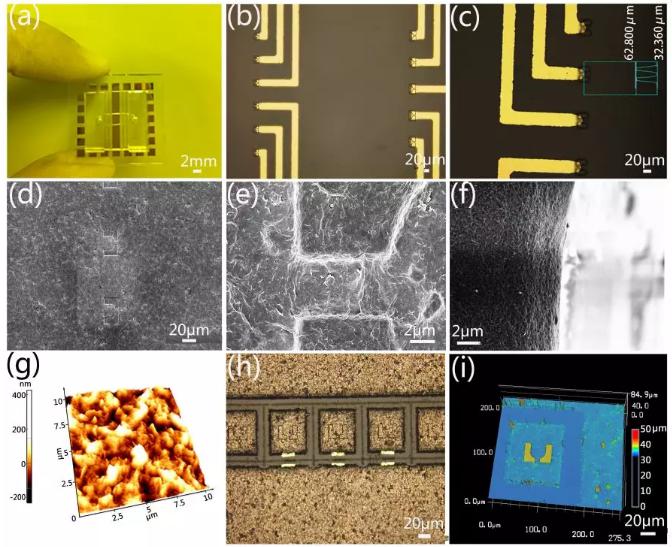
圖3(a)微流控芯片的實物圖,尺寸為2×2cm2;(b)用于單雙細胞捕獲的流道捕獲區域放大圖;(c)捕獲微槽的高度為30?m,比細胞直徑稍大;石墨烯片自組裝在微槽表面的(d)低倍和(e)高倍SEM圖;(f)單個石墨烯微槽側壁的SEM圖;(g)石墨烯微槽圓弧形內壁的原子力顯微圖;(h)激光將連續的石墨烯膜圖案化后的激光顯微圖片;(i)激光刻蝕后單個捕獲陣列的三維顯微圖

圖4 單細胞和雙細胞捕獲在相應微槽位置的顯微圖。(a)單細胞和(b)雙細胞捕獲的在二維金界面的微槽內;(c)單細胞和(d)雙細胞捕獲在三維石墨烯界面的微槽內;(e)單細胞和(f)雙細胞被三維石墨烯界面微槽緊緊的包裹;(g)單細胞和(h)雙細胞和石墨烯界面發生擠壓,并簇生出一定數量的脊
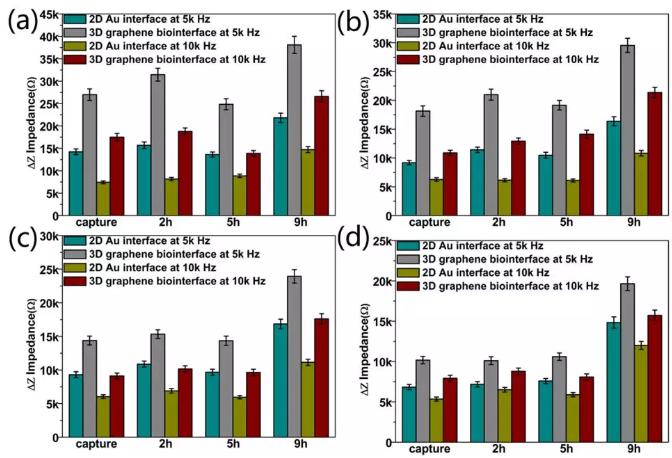
圖5 在頻率為5k和10k Hz下,對阻抗差值△Z進行的統計分析。數據代表五次重復實驗的平均值±標準差(n=100)。在不同的生理階段:包括捕獲、貼附(培養2小時)、遷移(培養2小時)和增殖(培養2小時),(a)單個早期乳腺癌細胞MCF-7和(b)單個中期乳腺癌細胞MDA-MB-231細胞分別接種在二維金界面和三維石墨烯界面的阻抗差值;(c)雙個早期乳腺癌細胞MCF-7和(d)雙個中期乳腺癌細胞MDA-MB-231細胞分別接種在二維金界面和三維石墨烯界面的阻抗差值;
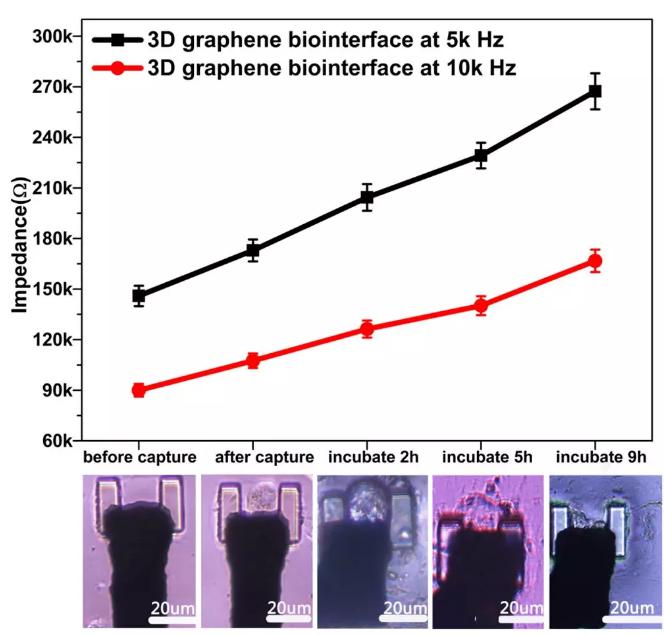
圖6通過三維石墨烯界面對單細胞進行實時的CCD記錄和電信號提取
浙江理工大學理學院劉愛萍教授和機械學院陳本永教授為該論文的共同通訊作者,第一作者為碩士生王夏華,浙江理工大學是該論文的第一單位和通訊單位。該工作得到了長江學者獎勵計劃創新研究團隊經費、國家自然科學基金、浙江省自然科學基金的資金支持。
該論文作者為:Xiahua Wang, Aiping Liu, Yun Xing, Hongwei Duan, WeizhongXu, Qi Zhou, Huaping Wu, Cen Chen, Benyong Chen
原文鏈接: https://www.sciencedirect.com/science/article/pii/S0956566318300204