核酸等溫?cái)U(kuò)增技術(shù)在微生物快速檢測(cè)中的研究進(jìn)展
核酸體外擴(kuò)增技術(shù)在分子生物和生物分析等領(lǐng) 域是一項(xiàng)重要的技術(shù),可用于定性、定量地分析和 檢測(cè)微量核酸,其在臨床醫(yī)學(xué)、檢驗(yàn)醫(yī)學(xué)、分子生物學(xué)、基因組學(xué)及食品安全等相關(guān)的各個(gè)領(lǐng)域發(fā)揮 著重要的作用,是生命科學(xué)發(fā)展不可或缺的一種重 要檢驗(yàn)方法。隨著生物技術(shù)在臨床和現(xiàn)場(chǎng)檢測(cè)方面 要求的不斷提升,越來越多的研究人員開始把目光專注于核酸體外擴(kuò)增新技術(shù)的研究。聚合酶鏈?zhǔn)椒磻?yīng)(Polymerase chain reaction,PCR)由于其特異性強(qiáng),靈敏度高等優(yōu)點(diǎn),是目前應(yīng)用最為廣泛的核酸體外擴(kuò)增技術(shù)。
聚合酶鏈?zhǔn)椒磻?yīng)
雖然 PCR 技術(shù)已經(jīng)應(yīng)用于分子生物 學(xué)等各個(gè)領(lǐng)域,但是該技術(shù)需要通過不斷的變化溫度才能實(shí)現(xiàn)核酸擴(kuò)增,因此,熱循環(huán)儀是不可或缺 的設(shè)備。然而,由于熱循環(huán)儀體積大、價(jià)格較高, 使其在基層的推廣和現(xiàn)場(chǎng)檢測(cè)受到了極大的限制。因此,陸續(xù)出現(xiàn)了不同的等溫?cái)U(kuò)增技術(shù),這些技術(shù)反應(yīng)溫度單一,不受熱循環(huán)儀的制約,正逐漸成為 PCR 的最佳替代方法。
20 世紀(jì) 90 年代初,很多研究人員看到了突破 傳統(tǒng)核酸體外擴(kuò)增技術(shù)將會(huì)帶來核酸體外擴(kuò)增的新 革命,從而嘗試創(chuàng)新發(fā)展無須熱變性的核酸恒溫?cái)U(kuò) 增技術(shù),并挖掘其在各領(lǐng)域應(yīng)用的潛力,這些核酸 等溫?cái)U(kuò)增的新技術(shù)應(yīng)用于生命科學(xué)及相關(guān)的各個(gè)領(lǐng) 域是必然趨勢(shì),也吸引了越來越多研究者的目光。
等溫?cái)U(kuò)增技術(shù)的基本原理和反應(yīng)成分各不相同, 依據(jù)等溫?cái)U(kuò)增的基本原理和步驟,本文將現(xiàn)有等溫 擴(kuò)增總結(jié)為兩大類,第一類是第一步反應(yīng)依賴于特 異性引物延伸的等溫?cái)U(kuò)增技術(shù) ;第二類是第一步反 應(yīng)依賴于限制性內(nèi)切酶的等溫?cái)U(kuò)增技術(shù)。本文概述 并比較分析了核酸等溫?cái)U(kuò)增技術(shù)的優(yōu)缺點(diǎn)及反應(yīng)原 理等,以期對(duì)相關(guān)領(lǐng)域的研究起到積極的促進(jìn)作用。 1 依賴于特異性引物延伸的等溫?cái)U(kuò)增技術(shù) 與傳統(tǒng) PCR 技術(shù)相似,為了保證目的片段特異 性擴(kuò)增,避免非特異產(chǎn)物的形成,在眾多等溫?cái)U(kuò)增 方法中,依然使用特異性引物退火延伸作為等溫?cái)U(kuò) 增的起始步驟,如依賴核酸序列擴(kuò)增技術(shù)、滾環(huán)擴(kuò) 增技術(shù)、環(huán)介導(dǎo)等溫?cái)U(kuò)增等。但是,由于引物與目 的模板退火結(jié)合的機(jī)理,這就不可避免地要對(duì)非單 鏈的起始靶物質(zhì)進(jìn)行高溫變性處理,這些方法并不 是徹底的等溫?cái)U(kuò)增。隨著技術(shù)的發(fā)展,為了避免高 溫?zé)嶙冃圆襟E,DNA 解旋酶、單鏈結(jié)合蛋白等被引 入等溫?cái)U(kuò)增體系。
1 依賴于特異性引物延伸的等溫?cái)U(kuò)增技術(shù)
與傳統(tǒng) PCR 技術(shù)相似,為了保證目的片段特異 性擴(kuò)增,避免非特異產(chǎn)物的形成,在眾多等溫?cái)U(kuò)增 方法中,依然使用特異性引物退火延伸作為等溫?cái)U(kuò) 增的起始步驟,如依賴核酸序列擴(kuò)增技術(shù)、滾環(huán)擴(kuò) 增技術(shù)、環(huán)介導(dǎo)等溫?cái)U(kuò)增等。但是,由于引物與目 的模板退火結(jié)合的機(jī)理,這就不可避免地要對(duì)非單 鏈的起始靶物質(zhì)進(jìn)行高溫變性處理,這些方法并不 是徹底的等溫?cái)U(kuò)增。隨著技術(shù)的發(fā)展,為了避免高 溫?zé)嶙冃圆襟E,DNA 解旋酶、單鏈結(jié)合蛋白等被引 入等溫?cái)U(kuò)增體系。
1.1依賴核酸序列擴(kuò)增技術(shù)
依賴核酸序列擴(kuò)增技術(shù)(Nucleic acid sequencebased amplification,NASBA) 于 1991 年 由 Compton 等首次提出,該方法結(jié)合了轉(zhuǎn)錄依賴擴(kuò)增系統(tǒng) (Transcription-based amplification system,TAS)和 自 主 序 列 復(fù) 制 系 統(tǒng)(Self-sustained sequence replication,3SR)2 種方法,并對(duì)其進(jìn)行改進(jìn)。
NASBA 技 術(shù) 與 3SR 相 似, 依 賴 AMV 逆 轉(zhuǎn) 錄 酶、RNase H 和 T7 RNA 聚合酶和一對(duì)引物來完成等 溫?cái)U(kuò)增,整個(gè)反應(yīng)包含非循環(huán)相和循環(huán)相。在對(duì)目 的 RNA 片段進(jìn)行擴(kuò)增時(shí),以指數(shù)擴(kuò)增方式大量生成 單鏈 RNA。不過,與 3SR 相比,NASBA 使用了 DMSO( 二 甲 基 亞 砜,Dimethyl sulfoxide,DMSO), 反應(yīng)溫度也適當(dāng)?shù)貜?37℃提高到 41℃,有效地提 高了反應(yīng)的特異性。隨后,Gene-Probe 公司基于 NASBA 成功研制出依賴轉(zhuǎn)錄介導(dǎo)擴(kuò)增(Transcription mediated amplification,TMA)檢測(cè)試劑盒,帶有 RNase H 活性和逆轉(zhuǎn)錄酶活性的 MMLV 逆轉(zhuǎn)錄酶(鼠 白血病逆轉(zhuǎn)錄酶)取代了 AMV 逆轉(zhuǎn)錄酶、RNase H。 由于 3SR,NASBA 和 TMA 的原理十分相似,所以 較多文獻(xiàn)將這 3 種技術(shù)或其中兩種視為同一種。
NASBA 除了應(yīng)用于 RNA 擴(kuò)增,經(jīng)過適當(dāng)?shù)母?良也可以擴(kuò)增 DNA:一種方法是使用限制性內(nèi) 切酶切割雙鏈 DNA,使其末端產(chǎn)生 T7 RNA 聚合酶 啟動(dòng)子序列;另一種方法是在非循環(huán)相里進(jìn)行兩 次 95℃變性,第一次變性,雙鏈 DNA 解離成單鏈 DNA,引物退火結(jié)合上后,在 AMV 反轉(zhuǎn)錄酶的作用 下,延伸形成新的雙鏈 DNA,接下來進(jìn)行第二次變 性,從而獲得了 5' 端含有 T7 RNA 聚合酶啟動(dòng)子序 列的單鏈 DNA。
NASBA 由于其快速高效、操作簡(jiǎn)便、設(shè)備要 求低、擴(kuò)增對(duì)象廣等特點(diǎn),已被廣泛應(yīng)用與發(fā)展。 Lau 等分別使用 NASBA- 電化學(xué)發(fā)光法(NASBAECL)和 NASBA- 酶連接寡核苷酸捕獲技術(shù)(NASBAEOC)兩種檢測(cè)方法檢測(cè)出口蹄疫病毒 ;Zhao 等 通過微流控芯片實(shí)時(shí)免疫 NASBA 檢測(cè)出水傳染病原 菌 ;Clancy 等開發(fā)出一種帶有擴(kuò)增內(nèi)標(biāo)的雙重 實(shí)時(shí) NASBA 診斷方法,成功檢測(cè)引起細(xì)菌性腦膜 炎的流感嗜血桿菌,腦膜炎奈瑟氏菌和腦炎鏈球菌。 H?nsvall 等使用實(shí)時(shí) NASBA 技術(shù)擴(kuò)增微小隱孢 子蟲和人隱孢子蟲的 MIC1 轉(zhuǎn)錄本,成功區(qū)分以上 兩種隱孢子蟲,在 10 μL 保存懸液中,檢測(cè)靈敏度 可低至 5 個(gè)隱孢子蟲卵囊。Zeng 等結(jié)合 NASBA 和 ELISA 兩種技術(shù)優(yōu)勢(shì),開發(fā)出 NASBA-ELISA 檢 測(cè)方法,實(shí)現(xiàn)高效簡(jiǎn)便檢測(cè)草魚呼腸孤病毒。盡管 NASBA 存在眾多優(yōu)勢(shì),但是其缺點(diǎn)也不能被忽視 : 首先,其不是完全意義上的等溫?cái)U(kuò)增技術(shù),不能進(jìn) 行一步擴(kuò)增 ;其次,酶的熱穩(wěn)定性差,不能在反應(yīng) 之前加入 ;最后,有效擴(kuò)增片段的長(zhǎng)度較短,僅100-250 bp 之間。
1.2 滾環(huán)擴(kuò)增技術(shù)
Fire 等 于 1995 年首次提出滾環(huán)擴(kuò)增技術(shù) (Rolling circle amplification,RCA),該技術(shù)是借鑒微 生物環(huán)狀 DNA 復(fù)制過程建立起來的一種體外等溫?cái)U(kuò) 增技術(shù)。在 RCA 反應(yīng)中,phi29 DNA 聚合酶是至關(guān) 重要的組成部分,具有持續(xù) DNA 合成能力和鏈置換 活性。RCA 的反應(yīng)模板通常是單鏈環(huán)狀 DNA,因此, 須對(duì)雙鏈 DNA 樣品進(jìn)行處理。如果樣品是雙鏈環(huán) 狀 DNA,則變性處理即可 ;但如果樣品是雙鏈線狀 DNA,在進(jìn)行變性處理后,還需用 T4 多核苷酸激酶 與 T4 DNA 連接酶環(huán)化單鏈線狀 DNA。RCA 按 引物數(shù)量可分為單引物 RCA,雙引物 RCA 和多引物 RCA。
1.2.1 單引物 RCA 只需要一條引物 P1 即可完成 擴(kuò)增。引物 P1 與單鏈環(huán)狀 DNA 結(jié)合后,在 phi29 DNA 聚合酶的作用下開始延伸,當(dāng)合成至自身 5' 端 時(shí),在 phi29 DNA 聚合酶鏈置換活性的作用下,5' 端 DNA 開始被置換下來,并繼續(xù)以環(huán)狀 DNA 為模 板進(jìn)行線性合成,最終生成一條具有重復(fù)序列且與 模板 DNA 完全互補(bǔ)的線狀單鏈 DNA。
1.2.2 雙引物 RCA 也稱為超分支滾環(huán)擴(kuò)增,在 單引物 RCA 的基礎(chǔ)上,再增加一條與擴(kuò)增產(chǎn)物互補(bǔ) 的引物 P2,P2 可與單引物 RCA 的產(chǎn)物退火延伸。 隨著反應(yīng)的進(jìn)行,P2 延伸鏈開始將下游 P2 的延伸 鏈置換下來,被置換下來的 P2 延伸鏈作為模板與 P1 結(jié)合。同樣地,上游 P1 延伸鏈會(huì)把下游 P1 延伸 鏈置換下來,如此形成指數(shù)擴(kuò)增,最終得到一系列 長(zhǎng)短不一的雙鏈 DNA 產(chǎn)物。
1.2.3 多引物 RCA由 phi29 DNA 聚合酶、單鏈 環(huán)狀 DNA 模板和隨機(jī)引物組成。多引物 RCA 原理 與雙引物 RCA 相似,隨機(jī)引物可以在環(huán)狀 DNA 的 不同位置同時(shí)延伸產(chǎn)生多個(gè)復(fù)制叉,然后在聚合酶 的作用下置換非模板鏈,在置換非模板鏈的同時(shí), 其他隨機(jī)引物也開始與非模板鏈退火延伸,進(jìn)而合 成雙鏈 DNA。與單引物 RCA 和雙引物 RCA 相 比,多引物 RCA 在合成速率和產(chǎn)量方面得到了明顯 提高。
到目前為止,出現(xiàn)了許多原理與 RCA 相似或衍 生于 RCA 的核酸擴(kuò)增技術(shù),如利用 T7 RNA 聚合酶 建立的以單鏈環(huán)狀 DNA 為模板的滾環(huán)擴(kuò)增技術(shù) ; 用于擴(kuò)增基因組 DNA 的多重置換擴(kuò)增技術(shù)(Multiple displacement amplification,MDA);利 用 鎖 式探針的信號(hào)擴(kuò)增 RCA。在微生物檢測(cè)方面, Rockett 等開發(fā)出依賴特異性引物的 dRCA 技術(shù), 在存在人源 DNA 的情況下,成功特異擴(kuò)增 BKV, HPyV6,HPyV7,TSPyV 和 STLPyV 等 7 種人多瘤病 毒,相比使用隨機(jī)引物的傳統(tǒng) RCA 法,dRCA 具有 更強(qiáng)的靈敏度和更高的產(chǎn)量。Wen 等使用 RCA 技術(shù)擴(kuò)增埃博拉病毒基因,同時(shí)基于氧化石墨烯吸 附 FAM 的性質(zhì),開發(fā)出一款新型熒光生物傳感器, 成功對(duì)擴(kuò)增產(chǎn)物進(jìn)行檢測(cè),檢出限低至 1.4 pM,即 使在 1% 人血清中,也可檢測(cè)出目的基因。Hao 等 基于 RCA 技術(shù)和 WS2 納米片,發(fā)明了一種用于檢測(cè) 金黃色葡萄球菌的加強(qiáng)化學(xué)發(fā)光能量共振轉(zhuǎn)移傳感 器,其檢出限可達(dá) 15 CFU/mL。RCA 與其他核酸擴(kuò) 增方法相比,其主要優(yōu)點(diǎn)為 :反應(yīng)機(jī)制簡(jiǎn)單,僅需 一種聚合酶即可實(shí)現(xiàn)核酸擴(kuò)增 ;靈敏度高,一條引 物可達(dá)到 105 倍擴(kuò)增,而兩條引物的擴(kuò)增效率可 達(dá)到 109 倍;不需要 PCR 儀,避免了熱循環(huán)過程 對(duì)反應(yīng)組分的影響。RCA 的不足之處在于 :前期處 理繁瑣,反應(yīng)模板要求是單鏈環(huán)狀 DNA,須對(duì)不符 合要求的樣品進(jìn)行退火和環(huán)化處理 ;反應(yīng)時(shí)間較長(zhǎng), 至少需要 4 h。
1.3 環(huán)介導(dǎo)等溫?cái)U(kuò)增
環(huán) 介 導(dǎo) 等 溫 擴(kuò) 增(Loop-mediated isothermal amplification,LAMP)是 Notomi 等 于 2000 年開 發(fā)的一種具有快速高效、特異性強(qiáng)、錄敏度高等特 點(diǎn)的等溫?cái)U(kuò)增技術(shù)。LAMP 的反應(yīng)過程可分為 3 個(gè) 階段 :循環(huán)模板合成階段、循環(huán)擴(kuò)增階段和伸長(zhǎng)再 循環(huán)階段。LAMP 使用 4 條引物,分別是正向 內(nèi)引物 FIP(包括 F1c 和 F2 兩部分序列,其中 c 代 表反向互補(bǔ)序列),反向內(nèi)引物 BIP(包括 B1c 和 B2),正向外引物 F3 和反向外引物 B3。
反應(yīng)初始,FIP 和 F3 先后與單鏈 DNA 模板結(jié) 合,引發(fā)循環(huán)模板合成,隨著 F3 的延伸,F(xiàn)IP 產(chǎn)生 的延伸鏈被置換出來,同時(shí),其 5' 端發(fā)生自我堿基 52 生物技術(shù)通報(bào) Biotechnology Bulletin 2017,Vol.33,No.7 配對(duì),形成環(huán)狀結(jié)構(gòu)。隨即,BIP 和 B3 以環(huán)狀結(jié)構(gòu) DNA 作為模板延伸,引發(fā)新一輪鏈置換反應(yīng),最終 形成一條啞鈴狀單鏈 DNA,即循環(huán)模板。進(jìn)入循環(huán) 擴(kuò)增階段后,啞鈴狀單鏈 DNA 3' 端以自身為模板 進(jìn)行延伸,打開 5' 端環(huán)狀結(jié)構(gòu),形成一條雙鏈莖環(huán) DNA。隨后,F(xiàn)IP 的 F2 區(qū)域與莖環(huán) DNA 環(huán)狀結(jié)構(gòu) 中的 F2c 區(qū)域互補(bǔ)配對(duì),發(fā)生延伸置換反應(yīng),自此 引發(fā)循環(huán)擴(kuò)增和伸長(zhǎng)再循環(huán)擴(kuò)增,進(jìn)入指數(shù)擴(kuò)增階 段。隨著 FIP 與 BIP 不斷與環(huán)狀結(jié)構(gòu)結(jié)合,鏈置換 反應(yīng)持續(xù)發(fā)生,最終大量生成不同長(zhǎng)度地多環(huán)花椰 菜結(jié)構(gòu) DNA,而每條 DNA 則是由交替反向重復(fù)靶 序列構(gòu)成。LAMP 原理雖然復(fù)雜,但是實(shí)際操 作簡(jiǎn)單,是一種簡(jiǎn)單、快速、有效的核酸擴(kuò)增技術(shù)。
LAMP 的主要優(yōu)點(diǎn)是特異性強(qiáng),多條互補(bǔ)序列 的引入使得即使存在非目的 DNA 的情況下,也不會(huì) 對(duì)靶序列的擴(kuò)增產(chǎn)生明顯影響 ;其次,LAMP 擴(kuò)增 效率高,由于存在多個(gè)循環(huán)體系,可實(shí)現(xiàn)高效擴(kuò)增, 其檢測(cè)限可低至幾個(gè)拷貝,遠(yuǎn)優(yōu)于 PCR。再次, LAMP 擴(kuò)增產(chǎn)物檢測(cè)方便,LAMP 會(huì)產(chǎn)生焦磷酸鎂白 色沉淀,通過肉眼或濁度儀即可判定體系是否發(fā)生 DNA 擴(kuò)增,適合用于即時(shí)檢測(cè)(Point-of-care testing, POTC)。在 10 多年的時(shí)間里,不斷有研究者從模板性質(zhì)、反應(yīng)抑制因子、環(huán)引物的引入及多 重檢測(cè)等方面對(duì) LAMP 進(jìn)行改進(jìn)。到目前為止, 由于引物設(shè)計(jì)的復(fù)雜性,僅發(fā)展到五重檢測(cè)。由于 LAMP 反應(yīng)成本低、擴(kuò)增時(shí)間短,無論是實(shí)驗(yàn)室研 究還是現(xiàn)場(chǎng)檢測(cè)都可以準(zhǔn)確、快速、靈敏的完成, 所以在基層檢驗(yàn)的推廣中具有良好的前景,是真正 普及型的核酸檢測(cè)方法。科學(xué)家們已經(jīng)將 LAMP 技 術(shù)成功應(yīng)用于病毒、致病菌及轉(zhuǎn)基因作物的檢測(cè)。盡管 LAMP 擴(kuò)增技術(shù)應(yīng)用十分廣泛,但是不 可避免的,LAMP 也存在一定的缺陷 :首先,由于 LAMP 產(chǎn)物鑒定結(jié)果只有擴(kuò)增與不擴(kuò)增,所以如果 發(fā)生非特異性擴(kuò)增,則不易識(shí)別。其次,其基本原 理是基于鏈置換和鏈取代兩種過程,LAMP 的擴(kuò)增 片段長(zhǎng)度一般在 200-300 bp,限制了 LAMP 在擴(kuò)增 長(zhǎng)片段方面的應(yīng)用。另外,由于高靈敏度,操作過 程中極易發(fā)生污染從而產(chǎn)生假陽性結(jié)果 ;LAMP 在 產(chǎn)物的回收、鑒定、克隆和單鏈分離等方面也存在 很大的操作障礙。 1.4 依賴解旋酶擴(kuò)增技術(shù) DNA 體內(nèi)復(fù)制主要依賴于 DNA 解旋酶、DNA 聚合酶以及各種輔助因子,根據(jù)以上復(fù)制機(jī)制, Vincent 等模擬出依賴解旋酶擴(kuò)增技術(shù)(Helicasedependent amplification,HDA)。HDA 是 一 種 徹 底 的等溫 DNA 體外擴(kuò)增技術(shù),目前,能夠達(dá)到反應(yīng) 全過程恒溫這一條件的體外等溫?cái)U(kuò)增技術(shù)屈指可 數(shù),其全程等溫的實(shí)現(xiàn)主要依賴于大腸桿菌 UvrD 解 旋酶。
HDA 的原理分為兩個(gè)階段 :第一階段,核酸解 旋酶打開 DNA 雙鏈,使目的模板鏈解鏈為單鏈狀態(tài); 單鏈結(jié)合蛋白與之結(jié)合,它的作用是保證單鏈結(jié)構(gòu) 不發(fā)生復(fù)性 ;第二階段,DNA 聚合酶各自以單鏈為 模板由引物為起始生成新鏈,新生成的雙鏈 DNA 作為下一輪擴(kuò)增的模板,如此反復(fù)循環(huán)擴(kuò)增實(shí)現(xiàn)靶 DNA 量的指數(shù)增加。HDA 的反應(yīng)步驟與 PCR 相似, 均包括雙鏈 DNA 解鏈、退火及延伸等步驟,但最大 的區(qū)別是采用酶維持單鏈作用替代升溫解雙鏈過程。 HDA 的出現(xiàn)引起了許多研究者的關(guān)注,并對(duì) 其進(jìn)行了大量的研究及改進(jìn)。An 等報(bào)道了嗜熱 HDA(Thermophilic helicase-dependent amplification, tHDA),該技術(shù)將原先使用的大腸桿菌 UvrD 換成了 來自騰沖嗜熱桿菌 Thermoanaerobacter tengcongensis 的耐熱 UvrD 解旋酶(Tte-UvrD)。該酶的應(yīng)用使反 應(yīng)可在 60-65℃之間進(jìn)行,溫度的提升增強(qiáng)了該技 術(shù)的靈敏度和特異性。Li 等 在未提取 DNA 的 前提下,直接使用 tHDA 成功檢測(cè)出人體血液中的 瘧原蟲,檢出限達(dá)到 50 拷貝。Motré 等研發(fā)出 了一種具有兩種不同功能的新酶,既可以解旋雙鏈 DNA,又可以進(jìn)行聚合反應(yīng),解決了解旋酶與聚合 酶協(xié)作效率低的問題。這種酶實(shí)質(zhì)上是 Tte-UvrD 和 Bst DNA 聚合酶通過卷曲螺旋域連接在一起的復(fù)合 體。該新酶的使用明顯提高了擴(kuò)增片段的長(zhǎng)度。除 了 前 面 提 到 的 兩 種 發(fā) 展 外,Xu 等 的 cHDA 和 Goldmeyer 等的 RT-tHDA 也對(duì)傳統(tǒng) HDA 進(jìn)行了 改良。
HDA 作為新型等溫核酸擴(kuò)增技術(shù)的優(yōu)勢(shì)在于 : 反應(yīng)全程溫度恒定,無需調(diào)節(jié)溫度,克服了傳統(tǒng) 2017,33(7) 王大洲等 :核酸等溫?cái)U(kuò)增技術(shù)在微生物快速檢測(cè)中的研究進(jìn)展 53 PCR 通過“變性 - 退火 - 延伸”過程的多次變溫循 環(huán)的瓶頸 ;反應(yīng)機(jī)制簡(jiǎn)單,僅需兩條簡(jiǎn)單的引物 ; 反應(yīng)時(shí)間較短,在 1-1.5 h 就可以實(shí)現(xiàn)擴(kuò)增。然而 HDA 也存在其缺陷,目前,常用的解旋酶是大腸桿 菌 MvrD 解旋酶,其解鏈速度為 20 bp/s,解旋速度 慢及持續(xù)能力差,因此 HDA 只適用于擴(kuò)增短片段。
1.5 重組酶聚合酶擴(kuò)增
繼 HDA 之 后,Piepenburg 等 于 2006 年 創(chuàng) 建了一種新型的全程等溫?cái)U(kuò)增技術(shù),其與 HDA 相 似,也使用酶來打開雙鏈 DNA,該技術(shù)稱為重組酶 聚 合 酶 擴(kuò) 增(Recombinase polymerase amplification, RPA)。RPA 是參照了 T4 噬菌體 DNA 復(fù)制系統(tǒng),該 反應(yīng)系統(tǒng)中除了需要一種常溫下能工作的 DNA 聚合 酶外,還包含噬菌體 μvsX 重組酶和單鏈 DNA 結(jié)合 酶 gp32,目前有些實(shí)驗(yàn)中還會(huì)加入輔助 μvsX 重組 酶的 μvsY 蛋白。重 組 酶 介 導(dǎo) 等 溫 擴(kuò) 增(Recombinase aid amplification,RAA) 是 基 于 RPA 的 一 種 改 良, 最 大的突破是重組酶的選擇上。RPA 使用的是噬菌 體 μvsX 重組酶,而 RAA 使用的是從細(xì)菌或真菌中 獲得的重組酶。這類酶不僅來源更為廣泛,而且最 重要的是它在 37℃恒溫下便可與引物緊密結(jié)合形成 酶 - 引物聚合體,反應(yīng)的溫度適應(yīng)性更強(qiáng)。
兩種方法的擴(kuò)增原理為 :引物常溫條件下與重 組酶結(jié)合形成一種結(jié)構(gòu)穩(wěn)定的復(fù)合物,當(dāng)引物在模 板 DNA 上搜索到與之完全互補(bǔ)的序列時(shí)發(fā)生退火 ; 退火發(fā)生的同時(shí)單鏈 DNA 結(jié)合蛋白被激發(fā),發(fā)生 作用使模板 DNA 保持單鏈狀態(tài),引物在 DNA 聚合 酶催化作用下延伸形成新的 DNA 互補(bǔ)鏈。RAA 和 RPA 反應(yīng)迅速快捷,通常在 1 h 內(nèi)即能得到可以用 瓊脂糖凝膠電泳檢測(cè)到的擴(kuò)增產(chǎn)量。
與 HDA 相 同, 用 于 檢 測(cè) PCR 產(chǎn) 物 的 方 法 也 可用于 RPA。Piepenburg 等設(shè)計(jì)了含有一個(gè)四氫呋 喃(Tetrahydrofuran,THF)分子的熒光探針,并在 THF 兩側(cè)的核苷酸上分別標(biāo)記一個(gè)報(bào)告熒光基團(tuán)和 一個(gè)淬滅熒光基團(tuán)。同時(shí),為了防止探針被作為引 物延伸,對(duì)其 3' 端進(jìn)行修飾。當(dāng)探針結(jié)合到模板 上時(shí),來自大腸桿菌的核酸內(nèi)切酶 IV(Nfo)識(shí)別 切割 THF,上游探針形成新的 3' 端,在 Bsu 聚合 酶的作用下,作為引物延伸,置換出下游探針,從 而使兩個(gè)熒光基團(tuán)分離,產(chǎn)生熒光信號(hào)。為了實(shí)現(xiàn) 無需實(shí)驗(yàn)室的即時(shí)檢測(cè),Piepenburg 等還設(shè)計(jì)了用 于側(cè)向流試紙條檢測(cè)的探針。該探針與熒光探針相 似,其正向引物標(biāo)記羧基熒光素(Carboxyfluorescein, FAM),反向引物標(biāo)記生物素,因此,在 Nfo 和 Bsu 聚合酶的作用下,最終生成帶有雙標(biāo)記的擴(kuò)增產(chǎn)物。 在試紙條上,擴(kuò)增產(chǎn)物先與帶有 FAM 抗體的膠體金 結(jié)合,再在檢測(cè)線上被生物素抗體捕捉,使檢測(cè)線 顯色,達(dá)到檢測(cè)目的。目前,英國(guó)公司 TwistDX Inc 基于以上兩種探針,已分別開發(fā)出 TwistAmp? exo 試 劑盒和 TwistAmp? nfo 試劑盒。TwistAmp? exo 試劑盒 是用于熒光檢測(cè),不過將 Nfo 替換成了核酸外切酶 III(exo),而 TwistAmp? nfo 試劑盒是用于試紙條檢測(cè)。 目前,RPA 已經(jīng)可以替代傳統(tǒng) PCR 實(shí)現(xiàn)檢測(cè),特別 是在病毒檢測(cè)方面頗具競(jìng)爭(zhēng)力,如裂谷熱病毒, 檢出限達(dá)到 19 個(gè)拷貝 ;艱難梭狀芽孢桿菌,檢 出限為 1 000 個(gè) DNA 拷貝,相當(dāng)于 1fg DNA ;布魯 氏菌,檢出限可低至 3 個(gè)拷貝。
RPA 其優(yōu)點(diǎn)在于 :反應(yīng)全程等溫進(jìn)行,不需熱 變性 ;引物設(shè)計(jì)簡(jiǎn)單 ;靈敏度高,最低能檢測(cè)出僅 含一個(gè)拷貝的樣品 ;特異性強(qiáng),可進(jìn)行多重 RPA。 RPA 的主要缺點(diǎn):由于引物(30-35 nt)與探針(46-54 nt)較長(zhǎng),不適合較短靶序列的檢測(cè);RPA 反應(yīng) 條件較苛刻,不適合直接擴(kuò)增粗樣品。
1.6 信號(hào)介導(dǎo)RNA擴(kuò)增技術(shù)
Wharam 等于 2001 年創(chuàng)建了信號(hào)介導(dǎo) RNA 擴(kuò) 增 技 術(shù)(Signal-mediated amplification of RNA technology,SMART)。SMART 與 NASBA 一 樣, 是 一種依賴 RNA 轉(zhuǎn)錄的等溫?cái)U(kuò)增技術(shù)。但是,SMART 不是通過增加靶序列拷貝數(shù)實(shí)現(xiàn)檢測(cè),而是通過信 號(hào)的放大來進(jìn)行。
SMART 體系含有兩條探針,分別是延伸探針 和模板探針。兩條探針均有一個(gè)區(qū)域可分別與靶序 列互補(bǔ)結(jié)合,同時(shí)還含有另一個(gè)可相互互補(bǔ)結(jié)合的 區(qū)域,從而兩條探針與靶序列形成 SMART 反應(yīng)中 關(guān)鍵的三通結(jié)構(gòu)(Three-way junction,3WJ)。延伸 探針在 Bst DNA 聚合酶的作用下,以模板探針為模 板,形成雙鏈 T7 RNA 聚合酶啟動(dòng)子和雙鏈轉(zhuǎn)錄模 54 生物技術(shù)通報(bào) Biotechnology Bulletin 2017,Vol.33,No.7 板。雙鏈啟動(dòng)子激活 T7 RNA 聚合酶不斷對(duì)轉(zhuǎn)錄模 板進(jìn)行轉(zhuǎn)錄,線性合成 RNA 信號(hào)。為了獲得更佳的 檢測(cè)靈敏度,可進(jìn)一步擴(kuò)增 RNA 信號(hào),將已生成 的 RNA 信號(hào)與另一條探針結(jié)合,該探針結(jié)構(gòu)與模 板探針結(jié)構(gòu)相似,也有 T7 RNA 聚合酶啟動(dòng)子以及 轉(zhuǎn)錄模板。后續(xù)的擴(kuò)增過程與先前的擴(kuò)增相同,雙 鏈 T7 RNA 聚合酶啟動(dòng)子和雙鏈轉(zhuǎn)錄模板生成,T7 RNA 聚合酶不斷對(duì)轉(zhuǎn)錄模板進(jìn)行轉(zhuǎn)錄,線性合成 新的 RNA 信號(hào)。RNA 信號(hào)用酶聯(lián)寡核苷酸吸附實(shí) 驗(yàn)(Enzyme-linked oligosorbent assay,ELOSA)進(jìn)行 檢測(cè)。
SMART 是一種特殊的等溫?cái)U(kuò)增技術(shù),通過擴(kuò)增 信號(hào)來檢測(cè)靶序列。Wharam 等使用 SMART 成功檢 測(cè)大腸桿菌基因組 DNA 和總 RNA 中的特異性序列, 甚至不需要提取核酸,直接進(jìn)行檢測(cè)。Hall 等 選用 g20 基因,使用 SMART 成功區(qū)分海洋噬藻體 的兩個(gè)種——S-PM2 和 S-BnM1,證明 SMART 可直 接檢測(cè)粗樣品。Murakami 等首次將 3WJ 結(jié)構(gòu)與 PG-RCA 聯(lián)合使用,成功檢測(cè)人 CD4mRNA,其中 PG-RCA 起著信號(hào)放大的作用 ;周敏等使用相同 的方法也成功檢測(cè)到腸道病毒 71 型,其檢測(cè)限低至 埃摩爾級(jí),靈敏度極強(qiáng)。經(jīng)實(shí)驗(yàn)驗(yàn)證,SMART 的主 要優(yōu)點(diǎn)為 :檢測(cè)范圍廣,既可檢測(cè) DNA,也可檢測(cè) RNA ;探針設(shè)計(jì)簡(jiǎn)單,只需設(shè)計(jì)與靶序列結(jié)合的區(qū) 域,其它的都是通用序列區(qū)域 ;特異性強(qiáng),只有形 成 3WJ 結(jié)構(gòu),RNA 信號(hào)才能生成 ;可直接檢測(cè)粗提 樣品。由于 SMART 還存在較多的不足,如反應(yīng) 時(shí)間長(zhǎng)、靶序列須是單鏈核酸片段、操作繁雜、靈 敏度較低等,目前相關(guān)的應(yīng)用報(bào)道還較少。SMART 在接下里的發(fā)展中,應(yīng)該專注于提高檢測(cè)靈敏度, 發(fā)展比 ELOSA 更高效的檢測(cè)方法,以及將擴(kuò)增與檢 測(cè)集中于一個(gè)試管中。
1.7 單引物等溫?cái)U(kuò)增
單引物等溫?cái)U(kuò)增技術(shù)(Single primer isothermal amplification,SPIA) 由 Kurn 等[56] 于 2005 年 首 次 報(bào)道。該技術(shù)主要通過使用一條嵌合引物“5'-RNADNA-3'”、RNase H 和具有強(qiáng)鏈置換活性的 DNA 聚合 酶來實(shí)現(xiàn)核酸等溫?cái)U(kuò)增。
反應(yīng)初期,嵌合引物與單鏈 DNA 模板互補(bǔ)結(jié) 合,在 DNA 聚合酶的聚合作用下開始延伸。同時(shí), RNase H 降解嵌合引物與模板形成的雜合鏈 DNA : RNA 中的 RNA 鏈,使未結(jié)合引物 RNA 部分與模 板結(jié)合,在 DNA 聚合酶的鏈置換活性下,新引物置 換舊引物的延伸產(chǎn)物,并開始延伸。與此同時(shí),新 引物與模板形成的雜合鏈中的 RNA 鏈再次被 RNase H 降解,如此循環(huán),進(jìn)行線性擴(kuò)增,從而產(chǎn)生大量 與單鏈 DNA 模板互補(bǔ)的單鏈 DNA 產(chǎn)物。若想限制 產(chǎn)物的長(zhǎng)度,可使用鏈終止多聚核苷酸(Blocker)。 Blocker 能 與 單 鏈 DNA 模 板 結(jié) 合, 當(dāng) 引 物 延 伸 至 blocker 時(shí),將停止延伸,這是因?yàn)?blocker 中的部分 堿基已被修飾,其與模板的結(jié)合力大大增強(qiáng),DNA 聚合酶無法置換出 blocker。為防止 blocker 發(fā)生延 伸反應(yīng),其 3' 端也需要進(jìn)行修飾。在 SPIA 的 基礎(chǔ)上,通過添加逆轉(zhuǎn)錄酶,可實(shí)現(xiàn)以 RNA 為模板 擴(kuò)增 DNA,該技術(shù)被稱為 Ribo-SPIA,其檢出限為 1 ng RNA,且具有很好的重復(fù)性。
SPIA 的主要優(yōu)點(diǎn)在于 :使用單引物,減少了 引物二聚體的形成 ;不受 RNA 干擾 ;反應(yīng)機(jī)制簡(jiǎn) 單,效率高。目前,其已被用于基于表達(dá)分析以及 病原菌檢測(cè),同時(shí)證明該技術(shù)在檢測(cè)沙門氏菌 方面比 qPCR(quantitative PCR,qPCR)具有更好的 靈敏度和特異性。但是,SPIA 也存在其缺點(diǎn) :模板 是單鏈核酸,需對(duì)雙鏈核酸進(jìn)行熱變性處理 ;需對(duì) blocker 進(jìn)行堿基修飾,提高擴(kuò)增成本 ;引物是嵌合 引物,設(shè)計(jì)較復(fù)雜。
1.8 嵌合引物引發(fā)的核酸等溫?cái)U(kuò)增
嵌合引物引發(fā)的核酸等溫?cái)U(kuò)增技術(shù)(Isothermal and chimeric primer-initiated amplification of nucleic acids,ICAN)與 SPIA 相 似, 均 主 要 依 靠 嵌 合引物、RNase H 和具有強(qiáng)鏈置換活性的 DNA 聚 合 酶, 不 過 ICAN 需 要 一 對(duì) 引 物, 同 時(shí) 引 物 中 的 DNA 與 RNA 序列排布位置與 SPIA 的引物相反,是 “5'-DNA-RNA-3'”構(gòu)型。ICAN 的擴(kuò)增產(chǎn)量高度依賴 引物濃度,隨著濃度的增高,產(chǎn)量顯著提升。
重復(fù)“nick-and-run”是 Mukai 等對(duì) ICAN 擴(kuò) 增機(jī)制提出的第一個(gè)假設(shè)。一條引物與模板結(jié)合后, 在 DNA 聚合酶的作用下開始延伸。隨即,RNase H 切割引物 RNA 部分與引物延伸產(chǎn)物之間的結(jié)合點(diǎn), 2017,33(7) 王大洲等 :核酸等溫?cái)U(kuò)增技術(shù)在微生物快速檢測(cè)中的研究進(jìn)展 55 形成缺口。DNA 聚合酶再次作用于 RNA 3' 端,在 置換出下游 DNA 的同時(shí),引物開始重新延伸,結(jié)合 點(diǎn)再次形成。RNase H 再次切割結(jié)合點(diǎn),在 DNA 聚 合酶的作用下,引物繼續(xù)重新延伸,進(jìn)入循環(huán)擴(kuò)增。 得到的單鏈 DNA 則作為另一條引物的模板進(jìn)行擴(kuò) 增,原理相同。依照重復(fù)“nick-and-run”擴(kuò)增機(jī)制, 擴(kuò)增產(chǎn)物中不應(yīng)含有 RNA 殘基,然而經(jīng)序列分析, 發(fā)現(xiàn)擴(kuò)增產(chǎn)物中存在著大量帶有 RNA 殘基的產(chǎn)物。 因此,Uemori 等認(rèn)為 ICAN 還存在著其它反應(yīng) 機(jī)制,他們分別提出了“multi-priming”和“templateswitching”兩種新機(jī)制。經(jīng)研究發(fā)現(xiàn),RNase H 引物 存在 2 個(gè)或更多 RNA 殘基時(shí),RNase H 會(huì)優(yōu)先切割 RNA 殘基 5' 端,并且是從引物上最后一個(gè) RNA 殘 基開始一個(gè)一個(gè)切割,即使只剩最后 1 個(gè) RNA 殘基, RNase H 也能有效切割殘基的 5' 端。但是,“multipriming”和“template-switching”兩種新機(jī)制都是基 于只切割引物上最后一個(gè) RNA 殘基 5' 端建立起來 的,因此,實(shí)際上,ICAN 的擴(kuò)增機(jī)制可能會(huì)更加復(fù)雜。
與其它核酸擴(kuò)增技術(shù)一樣,ICAN 也可用于病原 菌檢測(cè)。Isogai 等使用 ICAN 通過擴(kuò)增 invA 基因 來檢測(cè)死雞、蛋黃和牛糞中的沙門氏菌,且在死雞 沖洗液的檢測(cè)中,ICAN 的檢出率高于 PCR。Horii 等結(jié)合層析技術(shù),應(yīng)用 ICAN 成功快速檢測(cè)出淋 球菌對(duì)氟喹諾酮類藥物的抗藥性。Urasaki 等在 ICAN 的基礎(chǔ)上,引入環(huán)狀探針,對(duì) 44 個(gè)樣品中的 柑橘黃龍病菌進(jìn)行檢測(cè),相比常規(guī) PCR,ICAN 的檢 測(cè)時(shí)間可以至少節(jié)約 2 h,同時(shí)靈敏度更高。
綜上,ICAN 的主要優(yōu)點(diǎn)在于擴(kuò)增效率高、穩(wěn)定 性好、擴(kuò)增對(duì)象范圍廣,除了雙鏈 DNA,還可作用 于 cDNA :RNA 雜合鏈。但是,由于 ICAN 使用的 引物是嵌合引物,由 RNA 和 DNA 構(gòu)成,合成較復(fù)雜, 且擴(kuò)增機(jī)制不明確,進(jìn)而不利于該技術(shù)的發(fā)展。
2 依賴于切刻內(nèi)切酶的等溫?cái)U(kuò)增技術(shù)
解決不依賴高溫使 DNA 模板變性進(jìn)而引發(fā)擴(kuò) 增反應(yīng),是實(shí)現(xiàn)真正等溫?cái)U(kuò)增反應(yīng)的瓶頸。雖然, DNA 解旋酶等被用來產(chǎn)生 DNA 單鏈,但是效果一般, 反應(yīng)機(jī)制復(fù)雜。切刻內(nèi)切酶的發(fā)現(xiàn),使得等溫產(chǎn)生 DNA 單鏈成為可能。切刻內(nèi)切酶(Nicking Enzyme), 也稱為切口酶,由美國(guó) NEB 公司開發(fā),其為一種限 制性內(nèi)切酶,能夠識(shí)別特異性的核苷酸序列,并且 在序列內(nèi)部或首尾處發(fā)生單鏈切割 ;該過程對(duì)底物 DNA 沒有要求,即不需要有任何化學(xué)修飾。因此, 依賴切刻內(nèi)切酶作為反應(yīng)第一步的等溫?cái)U(kuò)增技術(shù)逐 漸被發(fā)展起來。
2.1 鏈置換擴(kuò)增技術(shù)(Strand displacement amplification,SDA)
置換擴(kuò)增技術(shù)是一種 DNA 體外等溫?cái)U(kuò)技術(shù),由 美國(guó) Beetonniekinson 研究中心 Walke博士團(tuán)隊(duì) 于 1992 年首次報(bào)道,此方法的建立標(biāo)志著一種新型 DNA 擴(kuò)增技術(shù)的誕生。
SDA 反應(yīng)全過程主要依賴于限制性內(nèi)切酶對(duì)半 硫代磷酸化堿基對(duì)應(yīng)互補(bǔ)鏈的切割作用,以及聚合 酶 exo-klenow 對(duì)切口的延伸作用和對(duì)下游 DNA 片段 的置換作用。SDA 由兩條引物 P1 和 P2 進(jìn)行擴(kuò)增, 兩條引物的 3' 端和 5' 端分別含有特異性結(jié)合序列和 Hinc II 識(shí)別序列,其具體的擴(kuò)增方式是 :限制性內(nèi) 切酶首先識(shí)別半硫代磷酸化堿基對(duì)應(yīng)的互補(bǔ)鏈,然 后切割該位置并產(chǎn)生單鏈切口 ;被切割部分的 5' 上 游端能夠作為一條引物,在具有鏈置換活性的 DNA 聚合酶的作用下從 5' 端向 3' 端延伸擴(kuò)增,從而剝 離原本已經(jīng)形成互補(bǔ)的 DNA 鏈 ;被取代下的單鏈 DNA 再與另一條引物結(jié)合,相同原理下延伸形成一 條新的雙鏈 DNA。SDA 反應(yīng)即是通過這種“切口 - 擴(kuò)增 - 置換”循環(huán)往復(fù)的過程,達(dá)到靶序列高效擴(kuò) 增的目的,其一般反應(yīng)條件為 37-40℃,經(jīng)過 2 h 循 環(huán)靶序列可得到 108 倍的擴(kuò)增量。
SDA 被發(fā)明后,在 20 余年的發(fā)展更新中,該 技術(shù)在細(xì)菌病毒檢測(cè)、核酸定量、重金屬檢測(cè)及芯 片雜交等多個(gè)方面有相關(guān)報(bào)道,同時(shí)也衍生出了 一些新方法。Little 等 將 SDA 與熒光共振能量 轉(zhuǎn)移技術(shù)結(jié)合,開發(fā)出新一代 DNA 探針系統(tǒng)—BD ProbeTecTM ET 系統(tǒng),用于檢測(cè)沙眼衣原體、淋病奈 瑟菌和人乳頭狀瘤病毒 ;Nuovo 等應(yīng)用 RT-SDA 檢測(cè)丙型肝炎病毒 ;Li 等研發(fā)出一種 SDA 結(jié)合 核酸酶高效檢測(cè)二價(jià)鉛離子的方法。
SDA 提供了一種可用于核酸診斷分析的擴(kuò)增方 法,具有等溫核酸擴(kuò)增的通用優(yōu)勢(shì) :無須熱變性、 特異高效、操作簡(jiǎn)便,只需一個(gè)恒溫器,大大簡(jiǎn)化 56 生物技術(shù)通報(bào) Biotechnology Bulletin 2017,Vol.33,No.7 了對(duì)所需儀器的要求。但是 SDA 由于反應(yīng)原理和 反應(yīng)體系的復(fù)雜性,不可避免的帶來了很多缺點(diǎn) : 非標(biāo)準(zhǔn)核苷酸的使用,經(jīng)硫基修飾的單核苷酸在價(jià) 格上比普通的單核苷酸高出很多倍,增加了反應(yīng)成 本;經(jīng)硫基修飾的單核苷酸不是 DNA 聚合酶的 天然底物,修飾的核苷酸與標(biāo)準(zhǔn)核苷酸存在競(jìng)爭(zhēng)關(guān) 系,聚合酶容易從 DNA 模板上掉落,大大降低了擴(kuò) 增效率降低了擴(kuò)增效率,所以,SDA 不可能合成較 長(zhǎng)的產(chǎn)物,一般不超過 200 bp;SDA 產(chǎn)物末 端帶有限制性核酸內(nèi)切酶的識(shí)別序列或其殘端,使 其不適合直接用于克隆,因此,該技術(shù)在基因工程 方面不占優(yōu)勢(shì);SDA 的等溫過程是兩步法,需要 首先有變溫過程打開雙鏈與引物退火,這就需要酶 體系在變溫環(huán)節(jié)后添加,增加了外源污染的可能性。
2.2 指數(shù)擴(kuò)增反應(yīng)(Exponential amplification reaction,EXPAR)
指數(shù)擴(kuò)增反應(yīng)由 Van Ness 等于 2003 年開 發(fā),該技術(shù)利用擴(kuò)增模板合成寡核苷酸,長(zhǎng)度為 8-16 mer,可用于位點(diǎn)多態(tài)性研究。反應(yīng)試劑中 的 N.BstNBI 切口酶在反應(yīng)中發(fā)揮著至關(guān)重要的作用, 因此,也可以把該技術(shù)稱為切口酶擴(kuò)增反應(yīng)(Nicking enzyme amplification,NEAR)。
EXPAR 能否順利開展,取決于觸發(fā)反應(yīng)。而觸 發(fā)反應(yīng)存在著不同的機(jī)制,其中最簡(jiǎn)單的一種機(jī)制 是依賴基因組 DNA 上存在著切口酶的識(shí)別序列。單 鏈基因組 DNA 與觸發(fā)模板退火結(jié)合,雙鏈識(shí)別序列 形成,激活切口酶切割單鏈基因組 DNA 識(shí)別序列, 缺口下游帶有 3' 懸掛的 DNA 序列,其在 60℃下自 動(dòng)解離,同時(shí)上游 DNA 序列以觸發(fā)模板為模板,在 DNA 聚合酶的作用下開始延伸,合成平末端的 DNA 序列。與此同時(shí),新形成的識(shí)別序列再次被切割, 缺口下游的 DNA 序列自動(dòng)解離,成為觸發(fā)子。上游 DNA 序列繼續(xù)延伸,切口酶繼續(xù)切割,從而線性生 成觸發(fā)子,反應(yīng)進(jìn)入指數(shù)擴(kuò)增階段。形成的觸發(fā)子 與擴(kuò)增模板 3' 端序列結(jié)合,在 DNA 聚合酶的作用 下開始延伸,形成雙鏈 DNA,切口酶切割識(shí)別序列, 形成缺口,缺口下游序列自動(dòng)解離,解離的單鏈片 段隨即與自由的擴(kuò)增模板結(jié)合形成短暫雙鏈結(jié)構(gòu), 在 DNA 聚合酶的作用下,解離的片段一旦開始延伸, 雙鏈結(jié)構(gòu)就會(huì)穩(wěn)定下來,不會(huì)輕易解離,最終生成 新的雙鏈 DNA。新生成的雙鏈 DNA 重復(fù)之前的過程, 繼續(xù)合成其它新的雙鏈 DNA。在這個(gè)過程中,每個(gè) 雙鏈 DNA 也會(huì)線性生成單鏈片段,從而達(dá)到指數(shù)擴(kuò) 增的目的。
EXPAR發(fā)展至今,已被廣泛應(yīng)用于檢測(cè)蛋白 質(zhì) 和 DNA。Nie 等基 于 EXPAR, 開 發(fā) 出 GQEXPAR,這是一種依賴 G- 四鏈體的雙重?cái)U(kuò)增技術(shù), 可通過聯(lián)合比色法檢測(cè) DNA。Ma 等創(chuàng)建了一種 用于檢測(cè)轉(zhuǎn)錄因子的技術(shù),該技術(shù)是在 GQ-EXPAR 的基礎(chǔ)上,再加入 RNA 轉(zhuǎn)錄技術(shù)實(shí)現(xiàn)檢測(cè)的目的。 Yu 等聯(lián)合 EXPAR 和 HCR 開發(fā)出一種電化學(xué)傳 感器,可對(duì) H7N9 病毒實(shí)現(xiàn)超靈敏檢測(cè)。EXPAR 的 主要優(yōu)點(diǎn)在于:反應(yīng)形式多,可滿足不同的擴(kuò)增需求; 反應(yīng)穩(wěn)定性好,速度快,靈敏度高。但由于反應(yīng)機(jī) 制復(fù)雜,產(chǎn)物產(chǎn)量易受擴(kuò)增模板限制,使得后期會(huì) 從指數(shù)擴(kuò)增轉(zhuǎn)變?yōu)榫€性擴(kuò)增。
2.3 切刻內(nèi)切酶介導(dǎo)等溫核酸擴(kuò)增技術(shù)(Nicking enzyme mediated amplification,NEMA)
切刻內(nèi)切酶介導(dǎo)等溫核酸擴(kuò)增技術(shù)是 2006 年 研發(fā)的一種全新的核酸恒溫?cái)U(kuò)增技術(shù),該技術(shù)是在 SDA 的基礎(chǔ)上發(fā)展而來的不依賴于特殊化學(xué)修飾的 等溫方法。NEMA 反應(yīng)體系中使用的切刻內(nèi)切酶, 是一種能夠識(shí)別特異性的位點(diǎn)并發(fā)生自然單鏈切割 產(chǎn)生缺口的酶,切刻內(nèi)切酶的使用克服了傳統(tǒng) SDA 反應(yīng)中需要添加化學(xué)修飾的非標(biāo)準(zhǔn)核苷酸的缺陷, 簡(jiǎn)化了反應(yīng)體系,提高了反應(yīng)效率,成本更低,并 且可合成長(zhǎng)鏈 DNA。
NEMA 反 應(yīng) 體 系 包 括 兩 對(duì) 引 物( 剝 離 引 物 B1/B2,切割引物 S1/S2)、一種具有鏈置換活性的 DNA 聚合酶、一種能夠識(shí)別特異性切割位點(diǎn)的切刻 內(nèi)切酶、額外添加的鎂離子以及適宜的緩沖溶液。 NEMA 技術(shù)是建立在 SDA 的原理技術(shù)上改進(jìn)發(fā)明的, 因此二者基本擴(kuò)增原理相似。NEMA 擴(kuò)增分為“切 割單鏈形成切口”和“鏈置換剝離舊鏈”兩個(gè)過程, 在待擴(kuò)增的 DNA 雙鏈模板上有一段切口酶特異識(shí)別 的序列,在切口酶的作用下只切割其中一條鏈,然 后 DNA 聚合酶以形成的切口為起點(diǎn),以未被切斷的 單鏈為引物延伸形成新鏈,置換舊鏈,產(chǎn)物作為新循環(huán)的模板不斷參與新一輪的指數(shù)擴(kuò)增。體系中還 存在另外一種模板,就是只上游或者下游一端引入 了切刻內(nèi)切酶識(shí)別位點(diǎn)的序列,這種狀態(tài)的靶序列 同樣是以不斷結(jié)合雜交互補(bǔ)的切割引物參與擴(kuò)增, 然后發(fā)生單鏈切口切割,在 DNA 聚合酶作用下鏈置 換,如此的往復(fù)循環(huán)過程。
相較于 SDA 和其他目前開發(fā)的等溫核酸技術(shù), NEMA 具有一些潛在的優(yōu)勢(shì) :酶體系和原材料體系 的簡(jiǎn)單減少了抑制因子的干擾 ;擴(kuò)增迅速,反應(yīng)時(shí) 間短,在 1 h 之內(nèi)就能達(dá)到電泳凝膠的觀察要求 ; 低成本,操作簡(jiǎn)單,對(duì)操作儀器的要求不高,為核 酸擴(kuò)增技術(shù)的推廣創(chuàng)造了條件。但是 NEMA 目前還 處于探索階段,多數(shù)應(yīng)用在微生物質(zhì)粒 DNA 的檢測(cè) 方面。
3 結(jié)語
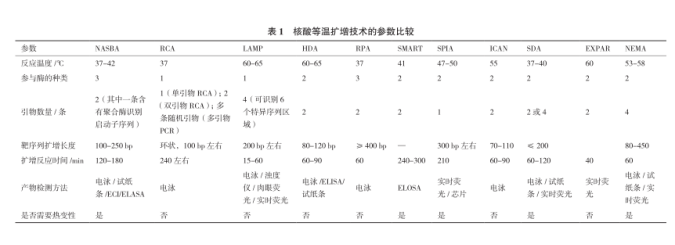
本文介紹了 10 余種等溫?cái)U(kuò)增技術(shù),其中每種技 術(shù)均有各自的優(yōu)勢(shì),表 1 比較了上文提到的幾種等 溫核酸擴(kuò)增方法的技術(shù)特點(diǎn)。盡管等溫?cái)U(kuò)增技術(shù)有 著普通 PCR 擴(kuò)增不可超越的優(yōu)勢(shì),但是有些缺點(diǎn)也 是不容忽視的。不過,隨著進(jìn)一步研究,對(duì)生物過 程的了解越來越深入,相信未來將會(huì)有更多更完善 的新型等溫?cái)U(kuò)增技術(shù)不斷涌現(xiàn)。
等溫?cái)U(kuò)增技術(shù)是在單一溫度下對(duì)靶序列進(jìn)行擴(kuò) 增或信號(hào)放大,不依賴便攜性差、價(jià)格昂貴的熱循 環(huán)儀,進(jìn)而在近 20 多年得到快速發(fā)展,尤其是在微 生物檢測(cè)領(lǐng)域中。我國(guó)現(xiàn)行標(biāo)準(zhǔn)(GB/T,SN/T 等) 中有多項(xiàng)采用了等溫檢測(cè)的方法,包括金黃色葡萄 球菌、產(chǎn)氣莢膜梭菌、創(chuàng)傷弧菌、阪崎腸桿菌、沙 門氏菌等致病菌 ;豬圓環(huán)病毒 2 型、家畜布魯氏菌、 焦枯病菌、甘蔗病原菌和豬瘟病毒等。等溫?cái)U(kuò)增技 術(shù)對(duì)儀器要求簡(jiǎn)單,僅以電池為電源的加熱器即可, 未來可在邊遠(yuǎn)地區(qū)和基層醫(yī)療單位等缺乏資金和先 進(jìn)檢測(cè)設(shè)備的地區(qū)大力推廣,使其具備快速診斷病 原體的能力。檢測(cè)時(shí)間短也是等溫?cái)U(kuò)增技術(shù)的優(yōu)勢(shì), 可在實(shí)時(shí)現(xiàn)場(chǎng)檢測(cè)與監(jiān)測(cè)領(lǐng)域推廣,如在突發(fā)公共 衛(wèi)生事件的現(xiàn)場(chǎng)診斷中,等溫技術(shù)對(duì)傳染性疾病的 早期發(fā)現(xiàn)和控制具有重要的意義。
歷經(jīng)了 20 余年的發(fā)展,在市場(chǎng)上仍然看不到任何已 經(jīng)被廣泛使用的相關(guān)設(shè)備。但是,導(dǎo)致這種現(xiàn)象的原因并非等溫?cái)U(kuò)增技術(shù)不適用,而是因?yàn)檫@是一個(gè) 復(fù)雜的工程問題,是一個(gè)涉及多領(lǐng)域的難題。想 研發(fā)出以核酸為靶物質(zhì)的便攜快速即時(shí)檢測(cè)設(shè)備, 我們需要對(duì)等溫?cái)U(kuò)增技術(shù)進(jìn)行更多的優(yōu)化,比如擴(kuò) 增速率,電力需求等等,同時(shí)需要解決將等溫?cái)U(kuò)增 與上下游操作結(jié)合在一起的技術(shù)難關(guān),如結(jié)合樣品 核酸的提取純化以及后期的擴(kuò)增產(chǎn)物檢測(cè)。隨著 微型品制造技術(shù)與等溫?cái)U(kuò)增技術(shù)的不斷提升,相 信在不久的將來將會(huì)出現(xiàn)突破性的進(jìn)展。
文獻(xiàn)來源:DOI :10.13560/j.cnki.biotech.bull.1985.2017-0106
作者:王大洲, 郭天笑,鄭實(shí),商穎,許文濤
(轉(zhuǎn)載僅供參考學(xué)習(xí)及傳遞有用信息,版權(quán)歸原作者所有,如侵犯權(quán)益,請(qǐng)聯(lián)系刪除)