幾種獲取單細胞的方法
單細胞測序已逐漸成為科研熱點,它解決了用組織樣本測序或樣本少時無法解決的細胞異質性難題,為科學家研究解析單個細胞的行為、機制、與機體的關系等提供了新方向。但是單細胞測序遇到的第一個難題就是:“如何獲取單細胞?”
1.有限稀釋法(Limiting Dilution)
有限稀釋法是根據細胞懸液濃度的計算,逐步稀釋得到一定體積內只有1個或少量細胞的方法(一般為1 ul,多數WGA/WTA試劑盒可容納投入體積)。
該方法操作簡單,無需特殊設備。但是,由于分選基于濃度計算,無法直接觀察,容易出現錯誤。

2.顯微操作法(Micromanipulator)
顯微操作法是將細胞懸液置于顯微鏡下進行單細胞挑選的方法,細胞挑選過程更直觀。低配版顯微操作,可以使用口吸管(英文名:Aspirator tube assembly)來進行;如果有經濟實力的客戶,可以使用顯微操作臺進行操作。首先,需要將細胞懸液進行稀釋,濃度在20個細胞每微升為宜。吸取細胞時,毛細管內不能有太多的緩沖液,保證毛細管內液體在1ul左右。然后將毛細管內液體吹入反應管中,反應管中預先加入的4 ul裂解液,這一過程切忌產生氣泡。
顯微操作的優勢在于能夠準確地控制單細胞的吸取與釋放;其缺點在于通量低,對操作人員的技術要求高。

3.熒光流式分選(FACS)
熒光流式分選能夠很好的實現大量細胞的分選過程,并且能夠做到精度高、通量大。但是它要求的細胞數量多,需要的樣本初始體積較大,使一些小體積或微量樣本 ( 如細針穿刺液 ) 分離單細胞受到了制約。該方法需要配備具有分選功能的流式細胞儀。在進行流式分選的過程中,需要先將樣本制成細胞懸液。不同形式的樣品,制作細胞懸液的方法也有所不同。
我們最為常見的樣本類型有:新鮮實體組織、外周血單核細胞(PBMC)及培養細胞等。其中,新鮮實體組織需要經過酶解法、機械法或者化學處理法等方法進行細胞分散,制作細胞懸液。在制作細胞懸液的過程中需要注意:①無菌操作;②操作過程要迅速;③染色和固定避免對細胞產生傷害;④在分選前進行細胞計數和活性統計。
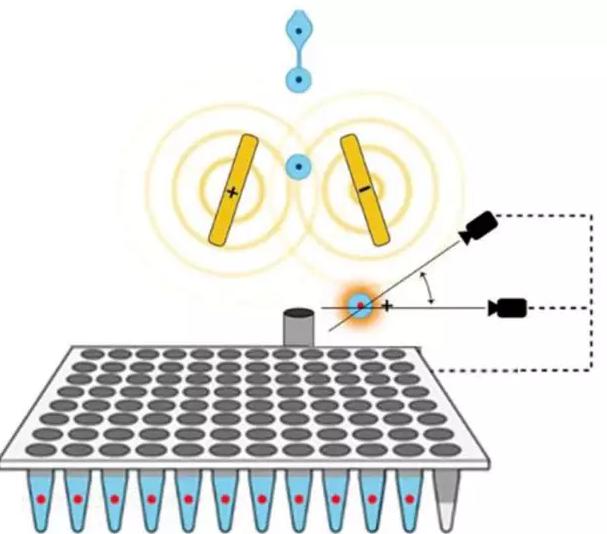
4.微流控技術(Microfluidics)
微流控技術可利用重力離心、流體力學、電場力等來捕獲細胞,也可以通過流體力學利用細胞大小、細胞表面標志物等進行分選,同時可以整合細胞培養、細胞捕獲分選、細胞裂解及后續的檢測分析基于一體。可直觀辨別目的細胞、實現高通量單細胞分離、自動化集成化。
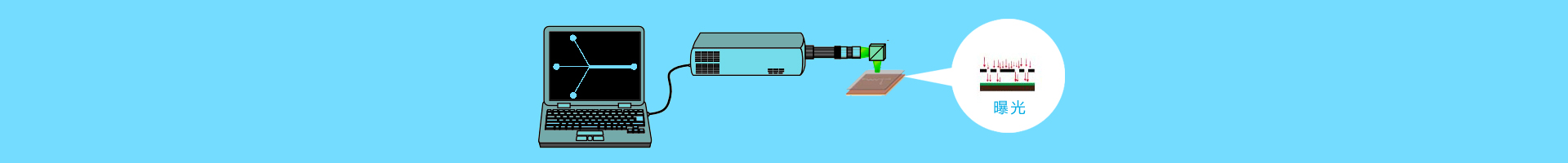
5.激光顯微切割技術(LCM)
對于切片組織樣本,我們需要用到激光顯微切割技術。該方法可直接觀察分離樣本,避免分離偏差;可以通過細胞形態觀察,分離稀有細胞;同時可以了解到細胞的位置信息。但是,該方法也存在著分離通量低的缺陷,而且分離的過程中可能會破壞細胞的完整性。
在進行該方法的細胞分離時需要注意:①需要選擇合適的細胞染料,避免染色過程中的RNA降解;②切片制作及細胞切割操作要盡量迅速;③分選下來的細胞附著在膜片上,可先將膜片上的核酸收集于大體積體系后再濃縮。
總之,細胞分選的方法多種多樣。我們需要根據實驗材料的特點、樣本的細胞數量以及實驗的設計思路等因素綜合考慮,選擇最合適的單細胞分選方法。