文獻No.357 基于TFF的灌流培養中采用大表面孔徑的微濾膜提高篩分系數
目前,基于膜分離系統的灌流細胞培養工藝中多采用中空纖維膜截留細胞。一般而言,膜污染和蛋白篩分系數下降是該類工藝中的主要挑戰。而且,為了更大程度地提高產品的收獲效率,需要在培養過程中更換濾膜,這會額外增加染菌風險和人力成本。此外,為了保證高收率和產品純度一致性,下游親和層析上樣時需要保證一定的裝載量。但是,灌流培養過程中每天收獲的蛋白的濃度不同,從而會增加下游連續流捕獲的復雜性,使得生產中很難將上下游連續收獲與捕獲進行銜接。
本文獻研究結果表明,在灌流細胞培養中,采用一種管徑0.2 μm的表面孔徑較大的中空纖維膜,可以有效緩解蛋白篩分系數下降的問題。在采用TFF系統的灌流培養中,采用此種膜首次避免了膜被亞微米級顆粒污染的問題。灌流培養中所采用的傳統的細胞截留膜,如果顆粒太小則無法被橫流的切向力沖走,所以直徑在20-200 nm范圍內的顆粒可能會沉積到膜表面。相比之下,表面孔徑較大的灌流膜結構可促進培養液中生物大分子(如DNA分子)的跨膜運動,從而可以極大程度地提高產品的篩分系數。
采用上述微濾膜,本文獻將上游灌流細胞培養和下游連續流捕獲直接有效地銜接起來,成功實現了29天的連續培養和捕獲過程。
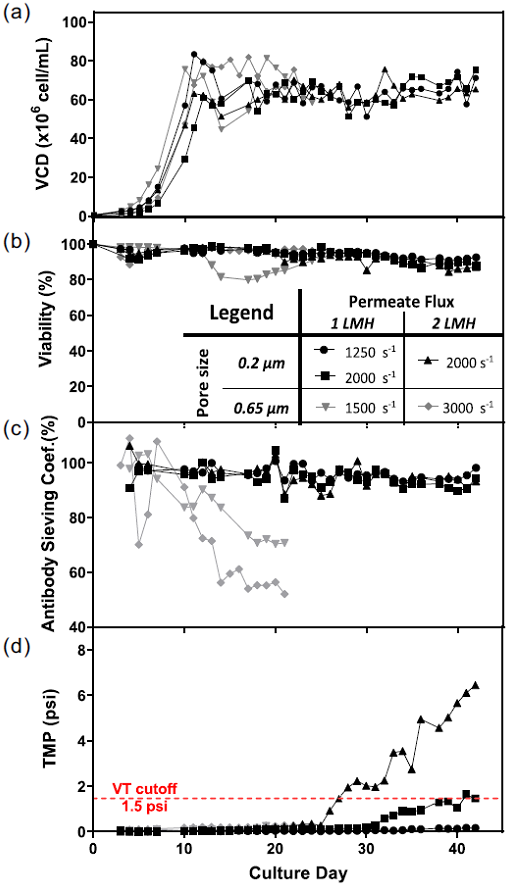
Figure 1. Tangential flow filtration-based perfusion cell cultures with nominal retention ratings of 0.2 um in black (1,250 s-1 and 1 LMH, 2,000 s-1 and 1 LMH, 2000 s-1 and 2 LMH, crossflow shear rate and permeate flux, respectively) and 0.65 μm in gray (1500 s-1 and 1 LMH, 3000 s-1 and 2 LMH, crossflow shear rate and permeate flux, respectively): (a) viable cell density (VCD); (b) viability; (c) antibody sieving coefficient; (d) transmembrane pressure (TMP). Increasing TMP indicates higher resistance for permeate flow, it was deemed high above the volumetric throughput (VT) cutoff of 1.5 psi (dash line) [Color figure can be viewed at wileyonlinelibrary.com].

Figure 2. Scanning electron microscopy topographies of the Microza membranes: (a) 0.2 μm UMP and (b) 0.65 μm UJP with ×5,500 and ×20,000 magnifications, respectively.
灌流培養工藝中,因細胞截留膜堵塞而造成的蛋白截留問題是一項重大的挑戰。CHO細胞培養過程中,需要保證無菌和無化學試劑殘留,所以無法使用污水處理中的曝氣清洗、化學試劑清洗等常見的中空纖維膜的清洗方法。因此,挑選可兼顧上下游需求的細胞截留膜尤為重要。一般認為,只有傳統的大管徑膜能夠改善蛋白篩分系數,而本文獻所述的案例則顛覆了這種思路。
研究結果表明,可以通過優化膜材質的方法提高上游蛋白的收獲效率。采用0.2 μm管徑的大表面孔徑膜能很好的銜接上游灌流培養連續收獲和下游連續捕獲,從而大大縮短生產周期,提高廠房利用率。
文獻出處
DOI: 10.1002/bit.27504
單位: Process Research and Development, Merck &Co., Inc.
引用: Pinto, NDS, Brower, M. Wide‐surface pore microfiltration membrane drastically improves sieving decay in TFF‐based perfusion cell culture and streamline chromatography integration for continuous bioprocessing. Biotechnology and Bioengineering. 2020; 117: 3336-3344.