癌癥監控哨兵——CTC檢測方案
現代科學的發展開啟了腫瘤個性化治療新紀元。目前腫瘤治療過程中遇到的最大挑戰是如何確定不同患者的最佳治療藥物。傳統的檢測手段和經驗用藥往往存在很大的個體療效差異,這也是腫瘤治療過程中的一大難題。
循環腫瘤細胞(Circulating Tumor Cell,CTC )是自發或因診療操作脫離實體瘤原發灶或轉移灶進入血液循環系統的腫瘤細胞。CTC是遠處器官轉移瘤的種子,與絕大多數癌癥的轉移復發相關。
1. 癌癥轉移機制
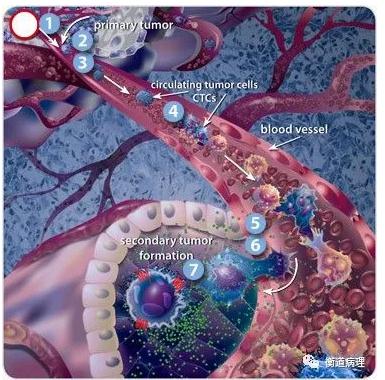
①細胞生長原位病灶
②細胞突破基底膜
③入侵
④隨血液流動
⑤黏附在毛細血管壁上
⑥從血管中逃離(溢出)
⑦通過增殖形成轉移
2. CTC的分類
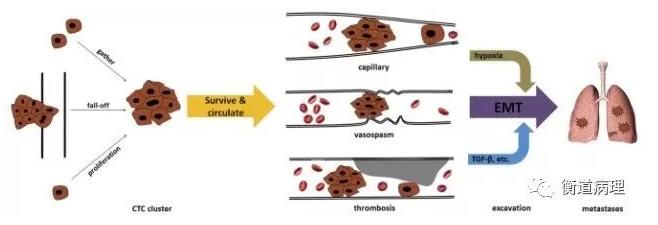
CTC以不同形態存在于外周血中,既有游離的單個CTC,也有聚集成團的細胞團——腫瘤微栓子(Circulating Tumor Microemboli,CTM)。腫瘤細胞在進入外周血循環的過程中會發生上皮-間質轉變(Epithelial Mesenchymal Transition,EMT),多數惡性腫瘤細胞在脫離原發灶的過程中發生EMT。研究表明,CTM和間質細胞表型CTC具有更強的轉移潛能。
3. CTC的富集
液體活檢技術發展至今一直面臨的最大問題就是如何在樣本起始量有限的情況下獲取本來就極其稀少的物質。前一篇講液體活檢“大馬車”ctDNA檢測的推文里提到ctDNA的特征:含量濃度低,而CTC的特征是游離細胞數量極少,每毫升血液里面含有的CTC 是個位數,而白細胞的數量級是106-107,紅細胞的數量則更多,高效分離和富集這些血液中的“不速之客”,是CTC檢測技術的基礎。
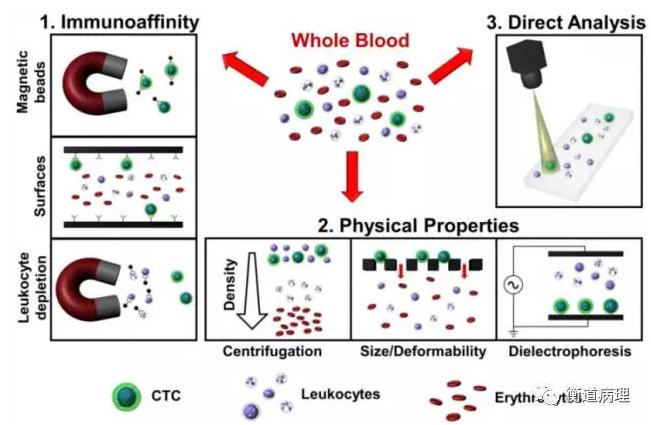
*從全血中分離CTC的方法
上圖直觀展示了三種捕獲CTC的方法:免疫親合法、物理特性富集、直接成像,較為成熟的是前兩種技術。免疫親和法主要是根據CTC 表面表達的特異性的蛋白將CTC 篩選出來,物理特性富集主要是根據CTC 的大小和密度等特性將這些細胞篩選出來。
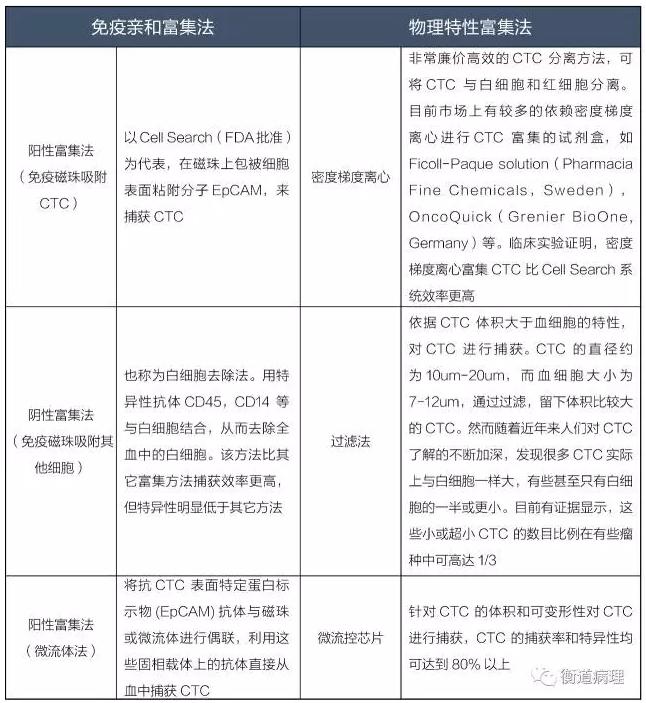
總而言之,物理特性富集法中密度梯度離心和過濾法操作簡單,成本低廉,不依賴細胞表面抗體的表達,捕獲的細胞數量多,能夠克服CTC 在蛋白表達上的異質性,但是無法克服CTC 在物理特性的異質性。生化特性法操作復雜,成本相對更高。未來,兩者結合的微流控芯片將是CTC 分離富集發展的趨勢。
4. CTC檢測的臨床應用
4.1腫瘤輔助診斷
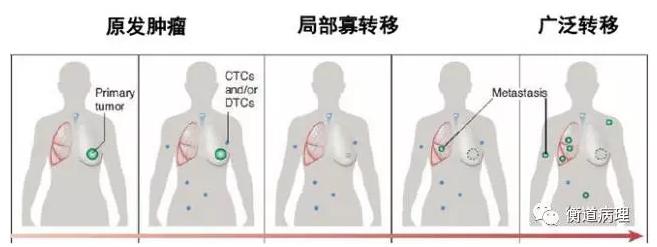
對尚未完善病理診斷的患者,CTC 可聯合影像學、血清學做為輔助判斷病灶良惡性的指標。同時,CTC是對原發灶與轉移灶信息的全面反映,可彌補現有傳統TNM 分期的不足,提示早期微轉移的存在風險。
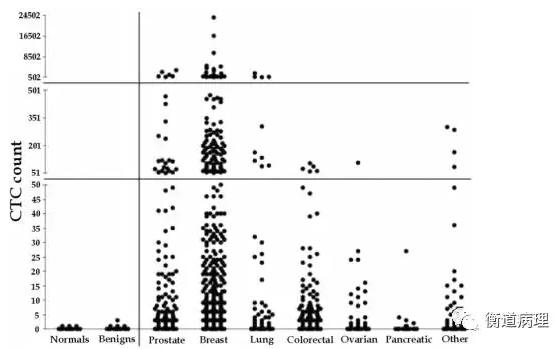
*顯示了不同癌癥在7.5ml血中CTC計數的差異(橫坐標分別代表:健康捐助者、良性的疾病患者、轉移性前列腺癌、乳腺癌、肺癌、卵巢癌、結腸癌、胰腺癌、和其他癌癥患者)
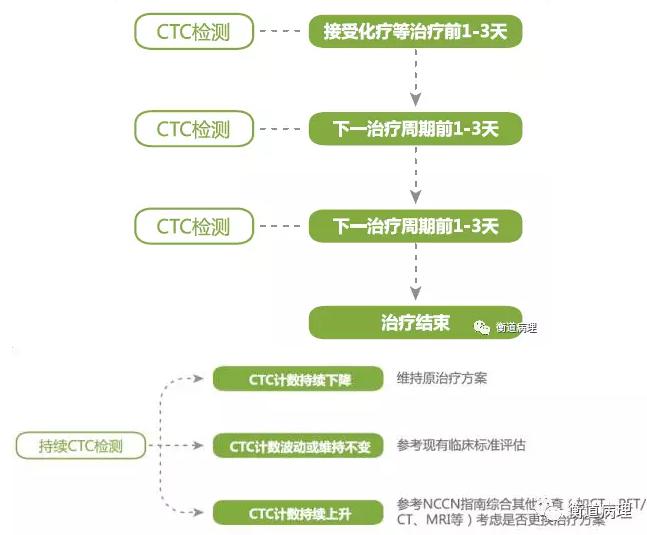
4.2藥物療效評估與耐藥檢測
因其無創便捷的特性可對包括術前新輔助化療、術后輔助化療、晚期放化療、靶向治療、生物免疫治療等在內的各階段治療進行實時監測治療效果,不僅可以實時快速判斷療效,還可動態監測耐藥發生。(建議治療前1-3天進行CTC計數檢測,治療后定期再次檢測,動態監測治療效果)
4.3 預后評估
*根據(A)影像學緩解情況,(B)影像學檢查±1個月內循環腫瘤細胞數目以及(C)影像學緩解情況結合影像學檢查±1個月內CTC數目,分析轉移性結直腸癌患者的總體生存狀況(總體生存期(OS)從基線采血時開始計算)
上圖的前瞻性多中心研究,采用免疫磁性分離法在基線時以及開始一線、二線或三線治療后對430例mCRC患者進行外周血CTC計數。治療前和治療期間的CTC數目是轉移性結直腸癌患者PFS和OS的一項獨立預測因子。除影像學檢查外, CTC能夠提供更多的預后信息。
4.4復發轉移監測
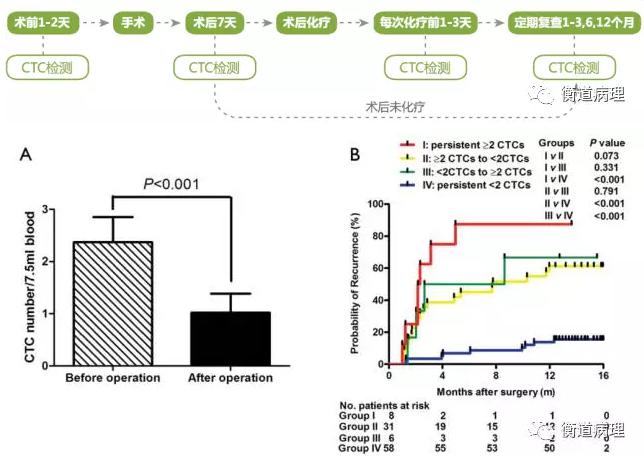
上述成果來自復旦大學的研究人員,在研究中觀察到手術后1個月,患者的CTC陽性率和CTC7.5(次方)值顯著下降。而CTC7.5(次方) 持續性<2的患者相比CTC7.5(次方) 持續性≥2的患者,前者復發率顯著較低。證實EpCAM+ CTC或可作為治療反應的一個實時監控參數,并有可能是肝癌復發一個有潛力的治療靶點。
4.5個體化治療
上述四點應用從CTC計數層面提供預后預測、復發風險評估和療效監測,更進一步的,分離CTC后,可連接下游的分子檢測技術,比如FISH平臺、PCR平臺、測序平臺等,來反映患者腫瘤的基因信息,指導個體化用藥。
標簽: ctc檢測