DNA納米光刻構建高度有序的微流控納米界面
大家好!今天跟大家分享一篇我們課題組最近發表在Angewandte Chemie International Edition的文章,題目為 “DNA Nanolithography Enables Highly Ordered Recognition Interface in Microfluidic Chip for Efficient Capture and Release of Circulating Tumor Cells”。作者設計了一個頂點懸垂核酸適體的四面體DNA納米結構,其作為具有納米精度的識別元件,可通過化學修飾的方法錨定到確定性側向位移(DLD)模式的微流控芯片上,然后實現循環腫瘤細胞(CTC)的高效捕獲和釋放,并通過數字液滴PCR擴增技術進行下游基因突變分析。
【背景介紹】
隨著微加工技術的發展,微流體技術的應用取得了重大的進展。納米級微流控芯片展示出巨大的應用潛力,納米-微米結構構筑的跨尺度界面,可不受傳質阻力的限制,從而改善界面上分子識別的動力學和熱力學。盡管已經開發出多種用于微米級結構的制造方法,但可重復地制備具有高精度尺寸的納米級結構在技術上仍然具有挑戰性。例如電子束光刻和納米壓印技術等雖可制備高分辨率納米結構但由于依賴大型昂貴設備及多步處理步驟,限制了其廣泛應用。
核酸適體是一條單鏈的DNA或RNA,能自發折疊成特異的三維結構以實現高親和力、高特異性識別靶標分子。與抗體相比,核酸適體用于CTC分析,顯示出許多獨特的優點,如良好的物理穩定性、低成本、易于改造修飾且批次間差異很小。目前已開發核酸適體的CTC微流控體系,大多是通過物理吸附、化學反應或生物分子識別將核酸適體連接到基質界面。然而,核酸適體的結構會受到鏈間纏繞以及適體與芯片界面之間非特異性相互作用的影響,在很大程度上限制了核酸適體對CTCs上所表達標志物的識別作用,致使目前適體微流控芯片對CTC捕獲效果不理想。
DNA分子由于其精確和可編程的核苷酸堿基配對原則,可以精準組裝成多種形狀、大小和尺寸的DNA納米結構。其中,四面體DNA納米結構(TDN)可作為定向修飾識別分子的剛性框架,有望作為功能分子和微流控界面之間的橋梁,避免常規微流控界面上核酸適體修飾產生的不良取向或擁擠效應,實現功能分子的均勻垂直界面修飾。
【設計思路】
作者首先設計了一個頂點懸垂核酸適體SYL3C(針對CTCs標志物上皮細胞黏附分子(EpCAM))的四面體DNA納米結構(SYL3C-TDN),然后通過化學修飾的方法錨定到確定性側向位移(DLD)模式的微流控芯片(ApTDN-Chip)上 (如圖1)。剛性的四面體DNA框架通過“DNA納米光刻”,可實現核酸適體呈高度有序且直立的納米形貌排布,有利于適體對CTC的識別作用。而DLD芯片通過尺寸選擇,可提高CTC與微柱之間的碰撞效率,同時最大程度地減少血細胞與微柱之間的碰撞。此外,四面體DNA支架還通過在界面上合理的空間間距降低了核酸適體的局部擁擠效應,使DNA核酸酶(DNaseⅠ)更易于與核酸適體作用,從而實現捕獲后細胞的有效釋放。最后可利用數字液滴PCR技術對釋放的CTC開展下游分子生物學分析。
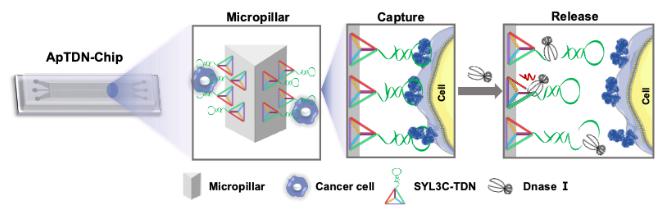
圖1. ApTDN-Chip的工作原理
【數據介紹】
SYL3C-TDN由一條含有核酸適體SYL3C片段的DNA長鏈(Apt-A)和三條DNA單鏈一步合成得到,與TDN有相似的高產率(超過85%),且重現性好。如圖2A、B所示,SYL3C-TDN 能夠維持核酸適體SYL3C特異性識別EpCAM表達陽性的SW480細胞系的能力,同時避免非特異性吸附。為了驗證TDN作為納米支架在界面上的優勢,作者將不同濃度的SYL3C-TDN和SYL3C通過鏈霉親和素和生物素作用修飾到磁珠上,然后投入相同數量的SW480細胞系。通過分析靶細胞的回收率,可以得到界面上SYL3C-TDN的平衡解離常數(Kd)為7.11 ± 0.98 nM(圖2D),相比于界面上SYL3C的親和能力降低了4倍(Kd=30.46 ± 3.20 nM,圖2C)。此外,在均相溶液中,SYL3C-TDN表現出與SYL3C相似的親和能力。由此可見,四面體DNA支架能夠提高核酸適體在界面上的識別熱力學。
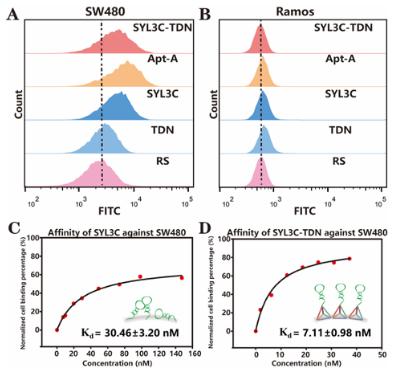
圖2. SYL3C-TDN識別能力的探究
為了進一步探究微流控芯片中DNA納米界面對于提高細胞捕獲效率的作用,作者設計了四種不同類型的微納界面(圖3A)。其中,生物素標記的DNA通過鏈霉親和素修飾到微流體界面是常用的芯片修飾策略。然而,鏈霉親和素以無序的形式隨機固定在微流體界面上,使得DNA以一個取向雜亂的狀態存在,這大大降低了DNA分子識別效率。而TDN作為分子支架,為核酸適體提供直立的取向和可控的間距,使得ApTDN-Chip展示出較高的捕獲效率(在緩沖液中87.4%),與另外三種微納米界面相比,捕獲效率提高了20-60%(圖3B)。此外,ApTDN-Chip在模擬病人血樣中仍保持較高的捕獲效率。同時,ApTDN-Chip對于白細胞和EpCAM表達陰性的Ramos細胞系的非特異性吸附與另外三種微納米界面是相似的(圖3B、C)。
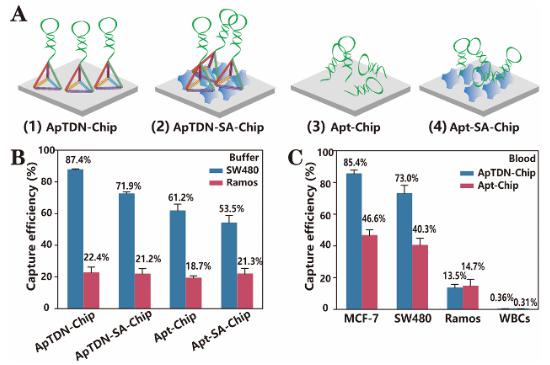
圖3.核酸適體不同微納米界面修飾的性能探究
高效無損釋放CTCs對于下游分析十分重要。近年來,研究人員開發了多種用于核酸適體的微流控芯片的釋放方案,如熱裂解、互補序列雜交和核酸酶水解。然而,它們的釋放效率往往會因為界面上局部擁擠效應或識別分子和界面的非特異性吸附,難以達到理想效果。基于此,四面體DNA支架為SYL3C-TDN在界面上提供合理的空間間距,能減小局部分子擁擠效應,使得DNaseⅠ更好的水解DNA序列。如圖4A,ApTDN-Chip中捕獲后的腫瘤細胞幾乎80%會被釋放,比Apt-Chip的釋放效率高約30%。這一釋放策略是通過水解核酸適體實現靶細胞的釋放,因而非特異性吸附的白細胞大部分仍留在微通道表面,使得釋放后CTCs的純度能夠進一步提升(圖4C)。此外,如圖4D、E所示,釋放后的細胞活性仍保持較高的水平(90.8%),有利于后續下游分子生物學分析。
CTC攜帶突變基因信息,在精準醫學中是一個潛在的生物標記物,例如一些對表皮生長因子受體(EGFR)抗體治療產生耐藥性的病人往往會存在KRAS基因突變,而隨著腫瘤的發展,KRAS突變也會隨之發生改變。因此,作者通過數字液滴PCR技術可對回收后的CTCs進行KRAS突變檢測。模擬病人樣本驗證ApTDN-Chip的捕獲-釋放策略,可檢測出低至每毫升20個 SW480細胞所攜帶的KRAS基因突變信息,檢測出每微升15.4的拷貝數(圖4F、G)。此外,ApTDN-Chip技術也被應用于病人外周血CTC捕獲及下游KRAS基因突變檢測,突變檢測結果和臨床組織穿刺結果具有良好的一致性。
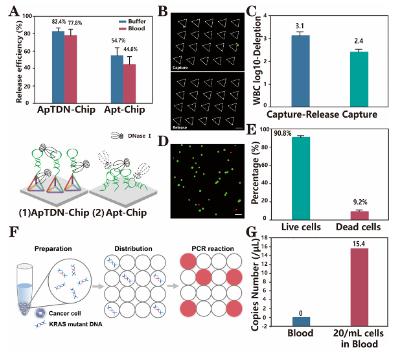
圖4. ApTDN-Chip下游分析探究
【總結】
本文展示了“DNA納米光刻”用于構建有序微流控芯片識別界面的潛力。剛性的四面體DNA支架為核酸適體提供高度有序的直立方向和可控間距,從而促進核酸適體在界面的有效識別。與傳統的納米級微流控界面加工方法相比,該平臺易于制造并表現出優異的性能。這種具有高精度尺寸的納米級框架結構作為識別分子和微流控界面之間的橋梁,改善了識別分子在界面修飾上的分子識別的熱力學。利用“DNA納米光刻”實現微流控界面功能化有望用于許多領域,如無創產前檢測、循環腫瘤外泌體和各種生物標記物的檢測以及細胞行為調控。
該工作由課題組和上海交通大學醫學院附屬仁濟醫院胃腸外科聯合攻關完成。2018級碩士研究生張佳露為論文的第一作者,宋彥齡、楊朝勇及胃腸外科趙剛為本文共同通訊作者。
撰稿人:張佳露(碩士生)
校稿:宋 佳
原文鏈接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202005974
免責聲明 文章來源:楊朝勇課題組 以傳播知識、有益學習和研究為宗旨。 轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除。